Introducción
La tendinopatía es un término paraguas que se utiliza para describir condiciones dolorosas crónicas y degenerativas que afectan la estructura del tendón. Esta patología suele estar asociada a cambios estructurales en el tendón, como la degeneración del colágeno, lo cual conlleva una reducción de la resistencia tendinosa (1,2). Los trastornos del tendón pueden afectar al propio tendón o a sus inserciones óseas, en cuyo caso se denominan entesopatías (3,4). Es importante señalar que la etiología, la fisiopatología y los mecanismos de reparación de las patologías tendinosas no se comprenden completamente y aún están siendo objeto de investigación y debate en la comunidad científica.
No obstante, las tendinopatías suelen caracterizarse por síntomas como dolor intenso, debilidad funcional en la zona afectada y limitación del rango de movimiento. Estas alteraciones pueden provocar una disfunción significativa, mayor riesgo de recaída y periodos prolongados de recuperación, lo que convierte a las tendinopatías en un reto clínico importante en la práctica ortopédica.
Las tendinopatías más frecuentes afectan al manguito rotador, tendón rotuliano, tendón de Aquiles y tendones del epicóndilo medial y lateral del codo. Los datos epidemiológicos muestran que dos de las tendinopatías más comunes son la tendinopatía rotuliana (TR) (5) y la epicondilitis lateral (EL) (6). Estas condiciones son especialmente prevalentes entre atletas y personas que realizan actividades repetitivas que someten a los tendones seleccionados a una carga y estrés mecánico excesivos, lo que conduce a su sobreúso.
La tendinopatía rotuliana (TR), comúnmente conocida como “rodilla del saltador”, se caracteriza por dolor en el tendón rotuliano, generalmente localizado en el polo inferior de la rótula (ápice rotuliano). La carga repetitiva, especialmente sin tiempos adecuados de recuperación, puede provocar estrés mecánico acumulativo y microtraumatismos. Estos cambios se consideran un factor clave en el desarrollo de esta patología. La TR es particularmente prevalente entre personas físicamente activas, especialmente deportistas que practican deportes de alto impacto como el baloncesto, voleibol o fútbol.
La epicondilitis lateral (EL), conocida como “codo de tenista”, es una condición que generalmente se produce por el estrés repetitivo sobre los tendones extensores del antebrazo que se insertan en el epicóndilo lateral, la prominencia ósea en la parte externa del codo. Este uso excesivo, habitual en actividades como el tenis, deportes de raqueta o trabajos manuales repetitivos, da lugar a microdesgarros acumulados y degeneración del tejido tendinoso.
La naturaleza compleja y la diversidad de factores que contribuyen al desarrollo de estas patologías dificultan la implementación de tratamientos dirigidos. Las opciones terapéuticas disponibles son limitadas y, en su mayoría, de carácter conservador. Los objetivos principales son reducir el dolor, recuperar la fuerza muscular y mejorar la calidad de vida del paciente. La escasa vascularización del tendón y la sobrecarga mecánica persistente hacen que el tratamiento y la recuperación sean prolongados y difíciles.
Las estrategias de tratamiento para las tendinopatías incluyen ejercicios excéntricos (7), manejo de la carga, fisioterapia, terapia de ondas de choque extracorpórea (ESWT) (8) y tratamientos regenerativos como plasma rico en plaquetas (PRP), ácido hialurónico (AH) e infiltraciones de corticoides.
La literatura actual y los datos clínicos demuestran que un tratamiento eficaz puede basarse en el uso de ácido hialurónico (AH) (9-11). Al inyectar el AH alrededor del tendón o en su vaina, sus propiedades viscoelásticas, antinflamatorias y lubricantes actúan de forma sinérgica para mejorar la función tendinosa, reducir el dolor y la rigidez y favorecer la cicatrización tisular. El AH también cumple un papel clave en la modulación de la respuesta inflamatoria local y en la inhibición de enzimas degradativas, lo cual contribuye a la restauración de la estructura y función del tendón (11,13).
El ácido hialurónico se presenta en una amplia variedad de formulaciones, que difieren en características clave como peso molecular, concentración, viscosidad y origen. Estas variaciones influyen significativamente en sus propiedades, incluyendo el tiempo de residencia en los tejidos, el potencial antinflamatorio y su capacidad para modular la síntesis de matriz extracelular. Como resultado, la eficacia clínica del AH en el tratamiento de las tendinopatías puede variar en función de la formulación específica utilizada, por lo que la selección adecuada del tipo de AH resulta esencial para lograr los mejores resultados terapéuticos.
Objetivos
El objetivo de este estudio fue evaluar la efectividad clínica a largo plazo de una terapia con dos inyecciones peritendinosas de ácido hialurónico (AH) al 1,6 % con MW de 1400-1600 kDa, administradas a intervalos de una semana, en pacientes con dos tipos de tendinopatías crónicas: tendinopatía rotuliana (TP) y epicondilitis lateral (LE). Específicamente, el estudio tuvo como objetivo determinar el impacto de la terapia en la recuperación funcional y la duración de la reducción del dolor durante un periodo de seguimiento de 12 meses para evaluar si el AH con estas propiedades proporciona efectos terapéuticos clínicamente significativos y sostenidos.
Pacientes y método
Es un estudio clínico multicéntrico, abierto no comparativo en condiciones de práctica clínica real en el periodo comprendido entre enero de 2019 y marzo de 2024.
Todos los procedimientos cumplieron con los principios éticos establecidos en la Declaración de Helsinki. Los pacientes fueron informados sobre los objetivos, procedimientos, beneficios potenciales y riesgos del estudio, y se obtuvo su consentimiento informado por escrito antes de su participación. Se garantizó la confidencialidad de los datos de los participantes y su derecho a retirarse del estudio en cualquier momento sin repercusiones en su atención médica.
Se incluyeron 60 pacientes con tendinopatías crónicas sintomáticas clínicamente diagnosticadas (30 sujetos en un grupo de TP y 30 en un grupo de LE, que afectaban solo un codo o una rodilla) en este estudio prospectivo e intervencionista. Los participantes recibieron dos inyecciones peritendinosas de Biolevox™ HA TENDON (hialuronato de sodio 32 mg, peso molecular 1400-1600 kDa, concentración 1,6 %, 2 ml, Biovico Sp. z o. o., Polonia) con un intervalo de 7 días. En cada día de tratamiento se inyectó una dosis de 2 ml de AH alrededor del sitio del tendón afectado utilizando una técnica de abanico. Las visitas de seguimiento (VS) se realizaron 1 mes, 6 meses y 12 meses después del tratamiento. Todos los pacientes fueron evaluados en los siguientes centros: Hospital Universitario Puerto Real, Hospital Universitario Puerta del Mar, Hospital Universitario de Jerez de la Frontera, Clínica Viamed Bahía de Cádiz y Unidad de Medicina Regenerativa de Cádiz, Hospital General Universitario de Ciudad Real, Hospital Quirónsalud Ciudad Real, Policlínica Traumatología Dr. Ítalo D’Ambrosio Bollici, Valdepeñas y Hospital San Pedro de Alcántara de Cáceres.
La eficacia clínica se evaluó a partir de la reducción del dolor que se evaluó mediante la Escala Visual Analógica (EVA), una herramienta que mide la intensidad del dolor en una línea de 100 mm, donde un extremo representa 0 (sin dolor) y el otro 100 (el dolor más intenso). Esta escala proporciona una medida clara y cuantificable de la intensidad del dolor, lo que permite una evaluación objetiva de la eficacia del tratamiento para aliviar las molestias (14).
Otra medida de resultado fue la mejoría del estado funcional que se midió mediante cuestionarios específicos para la tendinopatía, VISA-P (para la tendinopatía rotuliana) y PRTEE (para la epicondilitis lateral). El cuestionario del Instituto Victoriano de Evaluación Deportiva para los tendones rotuliana (VISA-P) mide el dolor, la función y la capacidad para practicar deportes. Una puntuación máxima de VISA-P de 100 indica que no hay dolor y que la función máxima y la capacidad ilimitada para practicar deportes (15). El cuestionario Patient-Rated Tennis Elbow Evaluation (PRTEE) mide el dolor y la discapacidad del antebrazo para evaluar el estado de salud de los pacientes con epicondilitis lateral. La puntuación oscila entre 0 (ausencia de dolor y función máxima) y 100 (dolor máximo y función mínima). Cuanto mayor es la puntuación, peor es el estado del paciente (16). Estos cuestionarios evalúan el impacto de la tendinopatía en las actividades diarias, la función y la calidad de vida de un paciente, proporcionando una visión integral del beneficio terapéutico más allá del alivio del dolor.
Los criterios de inclusión fueron: dolor crónico en el epicóndilo lateral o tendón rotuliano, persistente por más de 3 meses y menor de un año. Los criterios de exclusión fueron: inyección(es) local(es) previa(s) con corticosteroides en los 12 meses anteriores, rotura tendinosa previa, calcificaciones, reacciones alérgicas conocidas al AH o a cualquier otro componente de los ingredientes del producto sanitario, uso de anticoagulantes, trombopenia, infección en el lugar de la inyección, embarazo o lactancia. Para minimizar los efectos de confusión de los medicamentos analgésicos en las puntuaciones de dolor informadas, se implementó el protocolo de lavado. Se prohibió el uso de analgésicos (p. ej., opioides o antinflamatorios no esteroideos [AINE] durante al menos 72 horas antes de cada evaluación programada del dolor. A los participantes se les permitió usar paracetamol (máximo 3000 mg/día) según fuera necesario, pero se les exigió que se abstuvieran de usar durante un mínimo de 24 horas antes de la evaluación del dolor.
Todos los pacientes recibieron una pauta de fisioterapia estandarizada (3 sesiones semanales durante 4 semanas) y se documentaron otras intervenciones concomitantes.
Todos los pacientes inscritos fueron seguidos para detectar cualquier posible evento adverso. La evaluación de seguridad incluyó tanto los síntomas informados por el paciente como las evaluaciones clínicas durante las visitas de seguimiento.
Se recopilaron datos complementarios a través de una encuesta transversal de médicos con experiencia en el tratamiento de las tendinopatías crónicas mediante inyecciones de ácido hialurónico. Se desarrolló y administró un cuestionario estructurado para documentar las prácticas clínicas establecidas, incluidos los protocolos de procedimiento, la aplicación de la guía de ultrasonido y los enfoques para el manejo del dolor posterior a la inyección. El cuestionario tuvo como objetivo obtener respuestas estandarizadas que reflejaran las metodologías actuales y las variaciones de la práctica, con especial atención a las estrategias prevalecientes en la analgesia y la atención al paciente después del procedimiento.
Los resultados del estudio se analizaron mediante ANOVA de un factor, seguido de la prueba de comparaciones múltiples de Tukey (para las puntuaciones PRTEE y VISA-P) y una prueba de Kruskal-Wallis con la prueba de comparaciones múltiples de Dunn (para la EVA en el grupo LE y la EVA en el grupo PT). Aunque no se realizó un cálculo formal de poder estadístico, basamos la muestra en estudios previos similares y recomendaciones estándares (α = 0,05, potencia = 80 %), siguiendo los principios de estimación de tamaño en investigación clínica. Asimismo, tenemos la intención de utilizar una muestra calculada en próximos estudios confirmatorios.
Resultados
Sesenta pacientes han sido tratados con inyecciones de AH y 56 (93 %) completaron el estudio. 4 individuos (2 del grupo PT y 2 del grupo LE) no continuaron el seguimiento después de la primera inyección. La edad media de los pacientes fue de 49,4 ± 8,7 años. 33 pacientes eran hombres y 27 mujeres. Los pacientes tuvieron un promedio de 36,4 ± 7,6 semanas de dolor antes de ingresar al estudio (grupo PT 33,3 ± 7,9; Grupo LE 39,5 ± 6,1).
Tendinopatía patelar
El tratamiento del grupo de TP produjo una reducción significativa del dolor medido en la escala EVA observada en todas las visitas de seguimiento: 1 mes (p < 0,001), 6 y 12 meses después de la terapia en comparación con el valor basal (p < 0,0001) (Figura 1). Se observó una diferencia estadísticamente significativa entre las VS de 1 y 6 meses (p < 0,01). La puntuación de la EVA en el grupo de TP disminuyó de un valor basal de 8,2 ± 1,2 promedio a 5,1 ± 1,1 en la VS de 1 mes y a 3,2 ± 1,1 en la VS a los 6 meses. La puntuación media general de la EVA disminuyó en una media de 5,2 puntos cuando se comparó el valor basal con el valor de la visita de seguimiento a los 12 meses (Figura 1).
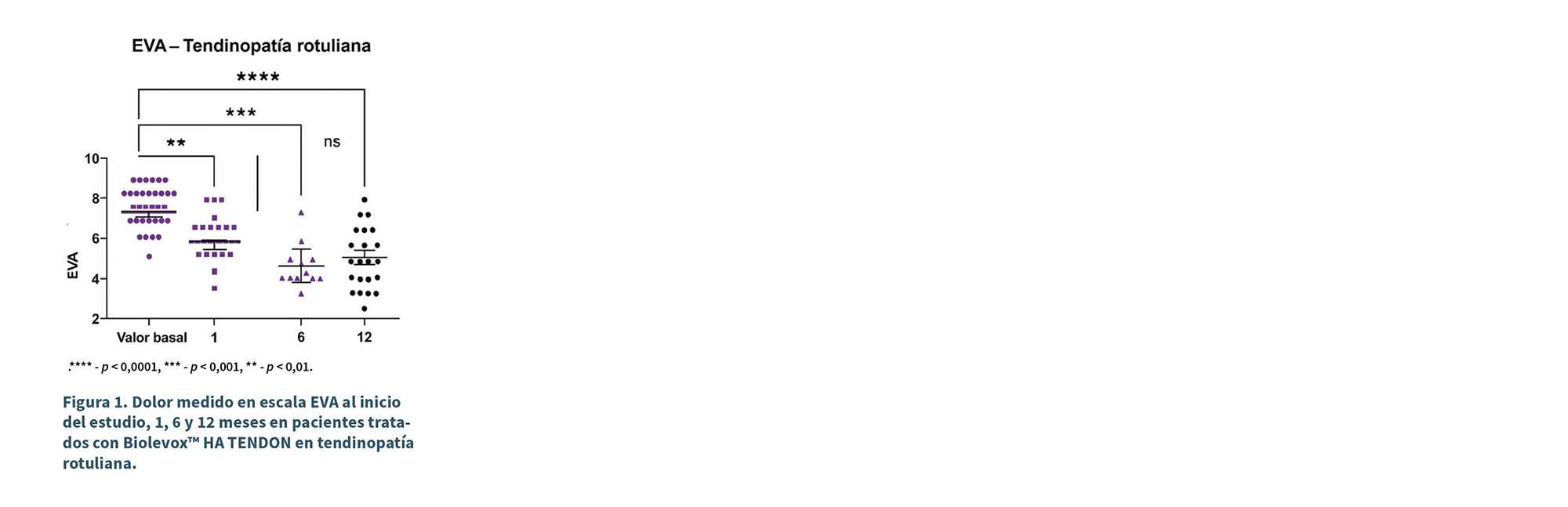
Se observó un aumento significativo en la puntuación VISA-P 1 mes después del tratamiento en comparación con el valor basal (p < 0,0001). También hubo un aumento significativo entre la visita basal y la VS a los 6 meses (p < 0,0001) y la visita basal y a los 12 meses (p < 0,0001) (Figura 2).

Epicondilitis lateral
Se observó una reducción significativa del dolor medida en la escala EVA en el grupo EL en todas las VS: 1 (p < 0,01), 6 y 12 meses después de la terapia (p < 0,0001) en comparación con el valor basal. También se observó una diferencia estadísticamente significativa en la puntuación de la EVA entre las VS de 1 y 6 meses (p < 0,001). La puntuación de la EVA en el grupo de EL disminuyó de un valor basal de 8,3 ± 1,1 a 4,8 ± 1,5 en la VS de 1,9 ± 1,9 en la VS a los 6 meses. La disminución media general del valor de la EVA desde el nivel basal hasta la visita de seguimiento a los 12 meses fue de 6,4 puntos (Figura 3).

Los resultados del cuestionario PRTEE mostraron una disminución significativa (p < 0,0001) desde su nivel basal hasta el valor observado a 1 mes (disminución de 30 puntos) y también una diferencia significativa entre la VS de 1 mes y la de 6 meses (p < 0,0001). Hubo una diferencia estadísticamente significativa entre las visitas basales y las de seguimiento a los 6 y 12 meses (p < 0,0001) cuando se compararon (Figura 4).

Los resultados de la evaluación de seguridad mostraron que, aparte del dolor localizado en el lugar de la inyección, no se observaron efectos adversos asociados con la terapia durante todo el estudio. No se informaron complicaciones, incluida la infección o los brotes de dolor resultantes de la inyección, entre ninguno de los pacientes.
Las respuestas de los médicos proporcionaron información sobre las prácticas actuales y las experiencias de los pacientes. El 26,8 % de los encuestados informó que los pacientes experimentaron dolor leve a moderado durante el procedimiento de inyección (Figura 5). Este malestar solía ser breve y bien tolerado; en todos los casos se mantuvo manejable. El 85,8 % de los médicos confirmaron que utilizan habitualmente la guía ecográfica cuando administran inyecciones de ácido hialurónico para tendinopatías y entesopatías. En respuesta a las preguntas sobre los protocolos posteriores a la inyección, se indicó que los analgésicos no se recetan de forma rutinaria a menos que el paciente informe una molestia significativa después del procedimiento. Solo al 13,4 % de los pacientes se les recomendó el uso de analgésicos después del tratamiento (Figura 6).


Discusión
La eficacia del ácido hialurónico (AH) ha sido probada en el tratamiento de las tendinopatías (17-21), lo que lo convierte en una opción cada vez más utilizada para el tratamiento de las enfermedades musculoesqueléticas. En el presente estudio, confirmamos la efectividad clínica del AH en las tendinopatías crónicas. Los resultados positivos que observamos en pacientes con tendinopatía rotuliana (TP) y epicondilitis lateral (EL) se pueden atribuir a varios factores clave de propiedades moleculares optimizadas. La formulación de AH utilizada en nuestro estudio se seleccionó cuidadosamente en función del peso molecular y la concentración.
Caracterizado por sus propiedades viscoelásticas y su actividad biológica, el AH desempeña un papel crucial en la modulación de la inflamación y en la promoción de la homeostasis de los tejidos. Los antecedentes moleculares que explican el papel del AH en el tratamiento de la tendinopatía se basan principalmente en la capacidad del AH para reducir activamente la producción de enzimas degradadoras del tejido tendinoso como MMP-1 y MMP-3 (19), determinando su papel anticatabólico. Es importante destacar que la eficacia clínica de la terapia con AH en el tratamiento de la tendinopatía depende en gran medida de las propiedades fisicoquímicas del AH. Especialmente, el peso molecular (PM) del AH desempeña un papel crucial en la determinación de su función biológica en los tejidos humanos, ya que los efectos terapéuticos se atribuyen en gran medida a la capacidad del HA para unirse a los receptores CD44. Solo el AH con un PM óptimamente alto tiene la longitud de cadena polimérica adecuada para unirse y agrupar eficazmente muchos receptores CD44, lo que conduce a la inducción de una respuesta celular anticatabólica adecuadamente eficiente a las señales de AH dadas (19,22). Dado que existe una falta general de comprensión con respecto a las diferencias en las propiedades intrínsecas de los productos de AH y su correlación con la eficacia clínica, nuestros hallazgos contribuyen al creciente cuerpo de evidencia que enfatiza la importancia del peso molecular y las características de formulación del AH. En el presente estudio, hemos demostrado que el AH con un peso molecular de aproximadamente 1500 kDa es clínicamente eficaz en el tratamiento de las tendinopatías crónicas. Este peso molecular parece lograr un equilibrio entre la viscoelasticidad adecuada para el soporte mecánico y la actividad biológica suficiente para modular la inflamación y promover la cicatrización de los tejidos. No todos los productos de AH pueden considerarse equivalentes, y una selección cuidadosa basada en las propiedades fisicoquímicas es crucial para optimizar los resultados terapéuticos. Además, la concentración óptima de AH afecta la eficacia, la biocompatibilidad y la inyectabilidad. Además, los efectos anticatabólicos del AH también han sido demostrados en artículos científicos en el contexto de la administración intrarticular, donde las evidencias sugieren que las formulaciones de AH adecuadamente seleccionadas pueden asegurar no solo el soporte mecánico sino también ejercer una actividad biológica significativa (23,24). Por lo tanto, los trastornos más comunes que afectan a las estructuras musculoesqueléticas (osteoartritis y tendinopatías, afecciones ortopédicas complicadas responsables de dolor y debilitamiento importantes) pueden tratarse con AH25.
Además del AH, uno de los tratamientos inyectables más populares para la tendinopatía es la terapia autóloga con plasma rico en plaquetas (PRP) que, mediante la liberación de factores de crecimiento en el tendón degenerado, promueve los procesos de reparación tisular. El PRP ha recibido una considerable atención por su potencial regenerativo y su alto perfil de seguridad, con estudios que indican una mejoría en el dolor y en la función tendinosa (26,27). Sin embargo, la eficacia a largo plazo de la terapia con PRP aún está bajo investigación. No obstante, la heterogeneidad en los métodos de preparación del PRP, la falta de protocolos de tratamiento estandarizados y los resultados inconsistentes en los ensayos controlados aleatorios han dado lugar a que el PRP no se convierta en un estándar universalmente aceptado.
Otra terapia inyectable utilizada en las tendinopatías son las inyecciones de corticosteroides. Los corticosteroides pueden proporcionar alivio a corto plazo, pero las inyecciones repetidas o de dosis altas pueden comprometer la integridad del tendón con el tiempo. Este debilitamiento se produce debido a los efectos de los esteroides sobre la síntesis de colágeno y la estructura del tejido tendinoso. En consecuencia, si bien las inyecciones de corticosteroides pueden ser beneficiosas en ciertas etapas agudas, su uso en la tendinopatía crónica debe considerarse cuidadosamente y sopesarse con estas posibles complicaciones. Las inyecciones de corticosteroides pueden empeorar los resultados a largo plazo de los pacientes y pueden causar eventos adversos graves, como la ruptura del tendón, que requieren reparación quirúrgica, seguida de un extenso proceso de rehabilitación. Dado que los tratamientos alternativos ofrecen resultados más seguros a largo plazo, la elección de los corticoides no parece estar justificada (28). En nuestro estudio, la evaluación de la seguridad confirmó que la terapia basada en dos inyecciones peritendinosas de AH es segura. La única preocupación era el dolor en el lugar de la inyección; sin embargo, los resultados de múltiples estudios han demostrado que el dolor en el lugar de la inyección fue consistentemente el evento adverso más común durante la terapia basada en inyecciones de AH en varias tendinopatías (29). Biolevox™ HA TENDON contiene AH de alta pureza, no derivado de animales, lo que reduce el riesgo de reacción inmunitaria o contaminación. El AH producido biotecnológicamente es el estándar para las inyecciones debido a su seguridad.
El presente estudio tiene las siguientes limitaciones. En primer lugar, no se utilizó ningún grupo control, lo que puede justificarse por problemas de elección adecuada, ya que todavía no existe un consenso sobre un tratamiento estándar en las tendinopatías. El uso de suero fisiológico al 0,9 % como placebo fue rechazado conscientemente por los autores, ya que puede retrasar tratamientos más efectivos en las tendinopatías. Tampoco se optó por la escarificación como grupo control, debido a que se evidencia una baja tasa de éxito. Por ello somos conscientes de que una de las principales limitaciones de este estudio es la ausencia de un grupo control activo o placebo, lo cual restringe la capacidad de establecer comparaciones directas. No obstante, este diseño exploratorio permitió evaluar el desempeño de Biolevox™ HA TENDON en condiciones reales. Actualmente se encuentra en desarrollo un ECA multicéntrico que incluirá grupo control frente a placebo, otras formulaciones de ácido hialurónico y tratamiento con corticosteroides, con el objetivo de consolidar los resultados obtenidos.
Aunque el estudio no incluyó evaluación imagenológica de forma sistemática, se recogieron datos exploratorios en una submuestra de pacientes que mostraron reducción del engrosamiento tendinoso y disminución del aporte vascular al doppler ecográfico, en correlación con la mejoría clínica. En futuros trabajos se incorporará el análisis estructural mediante ecografía musculoesquelética cuantitativa y RM funcional para robustecer los hallazgos.
Los puntos fuertes del diseño del estudio son una población suficiente de 60 pacientes, un programa de visitas de seguimiento regular y una evaluación basada en dos cuestionarios diferentes. Al combinar la evaluación del dolor y la mejora del estado funcional, se puede comprender completamente la eficacia general del tratamiento en el manejo de las tendinopatías. Sin embargo, los datos recopilados son un buen pronóstico para estudios posteriores en un grupo más grande y la participación de pacientes con otras tendinopatías.
En general, la elección del tratamiento para las tendinopatías debe depender del estadio y la gravedad de la tendinopatía, el perfil del paciente y la respuesta a los tratamientos previos. Nuestros resultados indican que los sujetos diagnosticados de TP y LE crónicos pueden beneficiarse de una intervención terapéutica con 2 inyecciones de Biolevox™ HA TENDON, que incluye la reducción del dolor, la facilitación del retorno a la capacidad funcional y la mejora de la calidad de vida. Estos beneficios se mantuvieron de manera constante durante todo el periodo de seguimiento hasta los 12 meses. El intervalo de una semana permite una respuesta terapéutica óptima, lo que garantiza beneficios sostenidos para los pacientes y minimiza el riesgo de efectos adversos. Este enfoque ofrece una opción prometedora para los médicos que tratan las tendinopatías crónicas y contribuye a mejorar los resultados de los pacientes.
Conclusiones
Los resultados de este estudio demuestran que la terapia basada en dos inyecciones peritendinosas de AH, caracterizadas por parámetros cuidadosamente seleccionados como un peso molecular específico (PM) de 1400-1600 kDa y una concentración del 1,6 %, constituye un tratamiento clínicamente eficaz para los individuos diagnosticados de tendinopatía rotuliana (TP) y epicondilitis lateral (EL). El PM dentro del rango de 1400-1600 kDa representa un PM óptimamente alto, lo que permite una respuesta terapéutica más eficiente, crucial para la efectividad del tratamiento. Las propiedades cuidadosamente seleccionadas del AH le permiten ofrecer beneficios sostenidos. Los médicos deben tener en cuenta las diversas características clínicas de los pacientes con tendinopatías y adaptar las estrategias de tratamiento en consecuencia. Dada la duración prolongada de los síntomas antes del tratamiento (un promedio de 36,4 ± 7,6 semanas), las reducciones observadas en el dolor y las mejoras en la función resaltan la efectividad potencial del tratamiento en el manejo de las tendinopatías de larga duración, y probablemente resistentes al tratamiento. Los datos recopilados proporcionan una base sólida para recomendar el AH en el tratamiento de las tendinopatías.
Reconocimientos
Este artículo es una versión revisada y ampliada de la presentación de un póster titulado “Efectividad de la inyección de ácido hialurónico en el tratamiento de la epicondilitis y la tendinopatía rotuliana”, que se presentó en el 21 Congreso de la Sociedad Española del Dolor en Málaga, en 2025.
Conflicto de intereses
Ninguno.
Financiación
Ninguna.
bibliografía
1. Almekinders LC. Tendinitis and Other Chronic Tendinopathies. J Am Acad Orthop Surg. 1998;6(3):157-64. DOI: 10.5435/00124635-199805000-00003.
2. Goldin M, Malanga GA. Tendinopathy: A Review of the Pathophysiology and Evidence for Treatment. Phys Sportsmed. 2013;41(3):36-49. DOI: 10.3810/psm.2013.09.2019.
3. Sudoł-Szopińska I, Kwiatkowska B, Prochorec-Sobieszek M, Maśliński W. Enthesopathies and enthesitis. Part 1. Etiopathogenesis. J Ultrason. 2015;15(60):72-84. DOI: 10.15557/JoU.2015.0006.
4. Slobodin G, Rozenbaum M, Boulman N, Rosner I. Varied Presentations of Enthesopathy. Semin Arthritis Rheum. 2007;37(2):119-26. DOI: 10.1016/j.semarthrit.2007.01.004.
5. Lian, Ø.B.; Engebretsen, L.; Bahr, R. Prevalence of Jumper’s Knee among Elite Athletes from Different Sports: A Cross-Sectional Study. Am J Sports Med. 2005;33(4):561-7. DOI: 10.1177/0363546504270454.
6. Abat F, Alfredson H, Cucchiarini M, Madry H, Marmotti A, Mouton C, et al. Current trends in tendinopathy: consensus of the ESSKA basic science committee. Part I: biology, biomechanics, anatomy and an exercise-based approach. J Exp Orthop. 2017;4(1):18. DOI: 10.1186/s40634-017-0092-6.
7. Irby A, Gutierrez J, Chamberlin C, Thomas SJ, Rosen AB. Clinical management of tendinopathy: A systematic review of systematic reviews evaluating the effectiveness of tendinopathy treatments. Scandinavian Med Sci Sports. 2020;30(10):1810-26. DOI: 10.1111/sms.13734.
8. Sussmilch-Leitch SP, Collins NJ, Bialocerkowski AE, Warden SJ, Crossley KM. Physical therapies for Achilles tendinopathy: systematic review and meta-analysis. J Foot Ankle Res. 2012;5(1):15. DOI: 10.1186/1757-1146-5-15.
9. Flores C, Balius R, Álvarez G, Buil MA, Varela L, Cano C, et al. Efficacy and Tolerability of Peritendinous Hyaluronic Acid in Patients with Supraspinatus Tendinopathy: a Multicenter, Randomized, Controlled Trial. Sports Med Open. 2017;3(1):22. DOI: 10.1186/s40798-017-0089-9.
10. Kumai T, Muneta T, Tsuchiya A, Shiraishi M, Ishizaki Y, Sugimoto K, et al. The short-term effect after a single injection of high-molecular-weight hyaluronic acid in patients with enthesopathies (lateral epicondylitis, patellar tendinopathy, insertional Achilles tendinopathy, and plantar fasciitis): a preliminary study. J Orthop Sci. 2014;19(4):603-11. DOI: 10.1007/s00776-014-0579-2.
11. Oliva F, Marsilio E, Asparago G, Frizziero A, Berardi AC, Maffulli N. The Impact of Hyaluronic Acid on Tendon Physiology and Its Clinical Application in Tendinopathies. Cells. 2021;10(11):3081. DOI: 10.3390/cells10113081.
12. Kaux JF, Samson A, Crielaard JM. Hyaluronic acid and tendon lesions. Muscles Ligaments Tendons J. 2016;5(4):264-9. DOI: 10.32098/mltj.04.2015.02.
13. Crimaldi S, Liguori S, Tamburrino P, Moretti A, Paoletta M, Toro G, et al. The Role of Hyaluronic Acid in Sport-Related Tendinopathies: A Narrative Review. Medicina (Kaunas). 2021;57(10):1088. DOI: 10.3390/medicina57101088.
14. Bijur PE, Silver W, Gallagher EJ. Reliability of the Visual Analog Scale for Measurement of Acute Pain. Acad Emerg Med. 2001;8(12):1153-7. DOI: 10.1111/j.1553-2712.2001.tb01132.x.
15. Hernandez-Sanchez S, Hidalgo MD, Gomez A. Responsiveness of the VISA-P scale for patellar tendinopathy in athletes. Br J Sports Med. 2014;48(6):453-7. DOI: 10.1136/bjsports-2012-091163.
16. Poltawski L, Watson T. Measuring clinically important change with the Patient-rated Tennis Elbow Evaluation. Hand Therapy. 2011;16(3):52-7. DOI: 10.1258/ht.2011.011013.
17. Mohebbi R, Rezasoltani Z, Mir M, Mohebbi M, Vatandoost S, Esmaily H. High- Versus Low-Molecular-Weight Hyaluronic Acid for the Treatment of Rotator Cuff Tendinopathy: A Triple-Blind Randomized Comparative Trial. Ann Pharmacother. 2021;55(10):1203-14. DOI: 10.1177/1060028021994297.
18. Rezasoltani Z, Esmaily H, Dadarkhah A, Rousta M, Mohebbi R, Vashaei F. Low Molecular-weight Hyaluronic Acid Versus Physiotherapy for the Treatment of Supraspinatus Tendinopathy: A Randomized Comparative Clinical Trial. J Am Acad Orthop Surg. 2021;29(19):e979-e992. DOI: 10.5435/JAAOS-D-20-01014.
19. Wu PT, Kuo LC, Su FC, Chen SY, Hsu TI, Li CY, et al. High-molecular-weight hyaluronic acid attenuated matrix metalloproteinase-1 and -3 expression via CD44 in tendinopathy. Sci Rep. 2017;7:40840. DOI: 10.1038/srep40840.
20. Zinger G, Bregman A, Safran O, Beyth S, Peyser A. Hyaluronic acid injections for chronic tennis elbow. BMC Sports Sci Med Rehabil. 2022;14(1):8. DOI: 10.1186/s13102-022-00399-0.
21. Tosun HB, Gumustas S, Agir I, Uludag A, Serbest S, Pepele D, et al. Comparison of the effects of sodium hyaluronate-chondroitin sulphate and corticosteroid in the treatment of lateral epicondylitis: a prospective randomized trial. J Orthop Sci. 2015;20(5):837-43. DOI: 10.1007/s00776-015-0747-z.
22. Julovi SM, Yasuda T, Shimizu M, Hiramitsu T, Nakamura T. Inhibition of interleukin-1β-stimulated production of matrix metalloproteinases by hyaluronan via CD44 in human articular cartilage. Arthritis Rheum. 2004;50(2):516-25. DOI: 10.1002/art.20004.
23. Goldberg VM, Buckwalter JA. Hyaluronans in the treatment of osteoarthritis of the knee: evidence for disease-modifying activity. Osteoarthritis Cartilage. 2005;13(3):216-24. DOI: 10.1016/j.joca.2004.11.010.
24. Troncoso JB, Fernández JR, Hubeny J, Grzywacz M, Silwanowick A, Bunikowska M, et al. Different hyaluronan concentrations determinate distinctive physicochemical and biological properties of the intra-articular gel but does not affect satisfactory clinical outcome. J Orthopaedic Rep. 2025;4(2):100445. DOI: 10.1016/j.jorep.2024.100445.
25. Costa FR, Costa Marques MR, Costa VC, Santos GS, Martins RA, Santos MDS, et al. Intra-Articular Hyaluronic Acid in Osteoarthritis and Tendinopathies: Molecular and Clinical Approaches. Biomedicines. 2023;11(4):1061. DOI: 10.3390/biomedicines11041061.
26. Nadeau-Vallée M, Ellassraoui S, Brulotte V. Platelet-rich plasma (PRP) injections as a second-line treatment in patients with tendinopathy-related chronic pain and failure of conservative treatment: a systematic review and meta-analysis. Pain Med. 2025:pnaf022. DOI: 10.1093/pm/pnaf022.
27. Čobec J, Kozinc Ž. Conservative Treatments for Patellar Tendinopathy: A Review of Recent High-Quality Evidence. BioMed. 2022;2(4):359-75. DOI: 10.3390/biomed2040028.
28. Coombes BK, Bisset L, Vicenzino B. Efficacy and safety of corticosteroid injections and other injections for management of tendinopathy: a systematic review of randomised controlled trials. Lancet. 2010;376(9754):1751-67. DOI: 10.1016/S0140-6736(10)61160-9.
29. Agostini F, de Sire A, Paoloni M, Finamore N, Ammendolia A, Mangone M, et al. Effects of hyaluronic acid injections on pain and functioning in patients affected by tendinopathies: A narrative review. J Back Musculoskelet Rehabil. 2022;35(5):949-61. DOI: 10.3233/BMR-210309.