Introducción
El dolor crónico es un problema de salud pública, cuyo abordaje resulta prioritario por su elevada prevalencia y su repercusión en la calidad de vida de los pacientes, ya que interfiere en su capacidad para desarrollar las actividades de la vida diaria, familiar y laboral. Se estimaba hasta hace unas fechas que uno de cada seis españoles sufre dolor crónico (17 %). La estrategia del Ministerio de Sanidad de 2015, plasmada en el documento “Prácticas seguras para el uso de opioides en pacientes con dolor crónico”, identificó el abordaje del dolor como una de las líneas prioritarias de trabajo para mejorar la salud de la población (1). No obstante, disponemos en la actualidad de datos obtenidos en el Barómetro del Dolor (2), presentado en abril de 2023, estudio que consistió en la realización de encuestas entre la población española en el año 2022, a fin de cuantificar el alcance de la enfermedad del dolor crónico en España. Para ello, se llevaron a cabo 7058 entrevistas a población española, muestreada según cuotas de sexo, edad y comunidad autónoma de residencia en el que el 25,9 % de la población encuestada padece dolor crónico, mientras que en Andalucía un 26,6 % de la población padece dolor crónico.
Los analgésicos opioides son un componente fundamental del tratamiento del dolor crónico, principalmente del dolor de origen oncológico, donde su administración no representa ninguna polémica. Su uso en el tratamiento del dolor crónico no oncológico (DCNO) ha aumentado considerablemente en los últimos años, surgiendo la controversia en cuanto a su eficacia a largo plazo y su seguridad frente a los beneficios que se obtienen. Este debate ha contribuido, en múltiples ocasiones, a un tratamiento insuficiente del dolor crónico. No obstante, es indudable que han contribuido a mejorar la calidad de vida de la humanidad a lo largo de los siglos, no consiguiéndose hasta la actualidad desarrollar un fármaco alternativo con mejores resultados. Sin embargo, hemos de aceptar que tienen una tasa de fracaso, efectos secundarios no desdeñables y que es posible su uso inadecuado, aunque la prescripción sea correcta (3).
La epidemia de opioides en Estados Unidos ha tenido un gran impacto, no solo en la cantidad y forma de prescribir estos fármacos, sino también en la estigmatización de los pacientes tratados con estos medicamentos, debido fundamentalmente a la creencia de que son fármacos asociados a un gran riesgo de adicción. Las medidas tomadas por las agencias y el gobierno de Estados Unidos han generado una nueva era de opiofobia que está generando un clima de “bloqueo al acceso al control del dolor, estigma y hostilidad en el sistema sanitario” (4).
Pocos son los estudios publicados sobre pacientes tratados con opioides durante periodos prolongados de tiempo, y en aquellos publicados presentan importantes limitaciones como ser meramente descriptivos. La mayoría son observacionales y de corta duración (menor de 12 semanas). La rigidez de los criterios de inclusión en los ensayos hace que sus resultados sean poco aplicables al perfil de pacientes tratados habitualmente en las consultas. Miden variables como la reducción e intensidad del dolor y excluyen la medición de variables como la mejora funcional, la calidad de vida y sin orientación hacia un posible deterioro del estado cognitivo de los pacientes (5).
Las razones por las que no existen ensayos clínicos aleatorizados a largo plazo en pacientes tratados con opioides pivotan, esencialmente, al hecho de la prohibición ética y deontológica de tratar con placebo a un paciente con dolor crónico durante más de 12 semanas. En todos los metanálisis siempre se reitera el mismo comentario a la hora de valorar el tratamiento con opioides a largo plazo: “No hay evidencia de eficacia a largo plazo”. Pero, como muy bien rebate Rose: “la ausencia de evidencia no es evidencia de ausencia” (6).
Poca o escasa literatura hay respecto al tiempo que se puede mantener el tratamiento con opioides. En un estudio realizado en la provincia de Granada en Atención Primaria (7), proporciona los siguientes datos: se identificaron 167 pacientes en tratamiento con opioides mayores. De ellos, solo en 26 pacientes (15,6 %) había sido indicado para dolor de origen oncológico. La duración media de los tratamientos (555 días), supera la del trabajo de Reid y cols. (8) en población con edad a partir de 65 años, que era de 388 días. En otro estudio poblacional realizado en Noruega (9) se relata que el 24 % de los pacientes con opioides seguía con el tratamiento cinco años después de iniciado.
La EFIC en su última recomendación consideró buena práctica clínica con fuerte consenso la interrupción del tratamiento con opioide por encima de las 12 semanas cuando los objetivos terapéuticos individuales no se alcancen o se produzcan eventos adversos intolerables. Si los objetivos terapéuticos se logran mediante otras medidas médicas. Si el paciente rechazó las pruebas de orina para detectar drogas en caso de sospecha de abuso de los opioides recetados o si el paciente usa el opioide prescrito de manera abusiva (10).
La prevalencia del dolor crónico se incrementa con la edad. Por otra parte, durante el envejecimiento se van a producir cambios orgánicos y mentales. Estas variaciones neuroanatómicas van a ocasionar un deterioro cognitivo especialmente patente en la disminución del rendimiento de distintos procesos con un notable decremento de los procesos perceptuales y sensitivos, con pérdida en la agudeza visual y auditiva, afectación de las habilidades espaciales y perceptivas (11). Asimismo, se evidencia una disminución de otras funciones cognitivas como la memoria a corto plazo. La atención es otro proceso que se altera; diversos autores mencionan que a mayor edad se presentan fallas en el control atencional, específicamente en la atención selectiva, y enlentecimiento de la velocidad del procesamiento de la información (12).
No olvidemos, por otro lado, que la esperanza de vida al nacimiento alcanzaría los 83,2 años en los hombres y los 87,7 en las mujeres para 2031, lo que supone una ganancia con respecto a los valores actuales de 2,2 y de 1,8 años, por lo que cada vez tenemos una población más envejecida (Instituto Nacional de Estadística. Esperanza de vida. Actualizado 2021). Estos datos son relevantes, pues diversos estudios epidemiológicos apuntan que, si bien la prevalencia del dolor crónico está entre el 12 y el 17 %, en la población con edad superior a los 70 años llega al 70 % (13).
Indudablemente, la longevidad, el dolor y los opioides son variables complicadas de separar. No obstante, no se dispone de una clara evidencia sobre el tratamiento con opioides en ancianos, ya que solo el 3,4 % de los ensayos aleatorizados incluyen a ancianos, y siempre menores de 85 años y sin pluripatología. Por este motivo, el uso de estos fármacos en la población geriátrica se basa en la experiencia y en los resultados de los estudios realizados en población adulta. No obstante, a pesar del evidente beneficio que producen en el alivio del dolor, se sigue expresando una pronunciada reticencia a su uso; de hecho, en muchas ocasiones, en ancianos que están en tratamiento con opioides, si sufren deterioro funcional o cognitivo se suele atribuir al opioide, aunque tenga una buena eficacia analgésica (14).
Algunos estudios apuntan a que los opioides, en mayor o menor medida, producen alteraciones cognitivas en el paciente geriátrico (15). No obstante, esta doctrina no es pacífica, aunque los ancianos presentan entre un 10-25 % más de riesgo de desarrollar efectos adversos que los jóvenes, lo que interfiere con el uso a largo plazo y el cumplimiento terapéutico. Un adecuado ajuste de dosis, prevención e información sobre los efectos secundarios mejora la adherencia y la eficacia de estos fármacos. Según Barber, la posibilidad de sufrir efectos secundarios, especialmente con daños en órganos, es superior para los AINE que para los opioides (16).
Otras publicaciones apuntan en sentido contrario, es decir, que los trastornos cognitivos no son tan significativos ni muestran una relación directa con el tratamiento reglado y controlado de opioides (17,18).
Esta disquisición sobre los efectos del uso prolongado de opioides sobre la cognición y otros aspectos de la vida de los pacientes nos llevó a diseñar este estudio, comparando dos grupos: uno conformado por pacientes en tratamiento con opioides mayores durante más de un año, y otro grupo control compuesto por no consumidores de opioides, mayores ni menores.
Material y métodos
Se trata de un estudio epidemiológico, observacional, comparativo, con dos grupos de pacientes: un grupo de pacientes con dolor crónico no oncológico tratados con opioides potentes, al menos, durante un año en la Unidad del Dolor del Hospital de Guadix, y otro grupo de pacientes no consumidores de opioides, ni potentes ni débiles.
Criterios de inclusión
Se incluyeron en este estudio a todos los pacientes con dolor crónico no oncológico, mayores de edad, que estuvieran en tratamiento con opioides potentes, al menos durante un año, de forma ininterrumpida, y que aceptaron el consentimiento informado, bien escrito o verbal, para participar en el mismo.
Criterios de exclusión
Pacientes con dolor crónico oncológico.
Los que se negaron a aceptar el consentimiento informado.
La selección del paciente se hizo de forma consecutiva y cumpliendo los criterios de selección cuando acudían a la consulta de la Unidad.
El grupo control se seleccionó de forma aleatorizada entre las personas pertenecientes al Grupo de Pacientes de la Escuela Andaluza de Salud Pública y usuarios del Programa de Mayores de Cruz Roja (Granada) sin tratamiento con opioides potentes ni débiles.
Objetivo principal
El objetivo principal es comprobar el grado de cognición en pacientes con DCNO tratados con opioides potentes durante más de un año y compararlo con el grupo control.
Para el grupo con opioides se definieron las siguientes variables:
— Datos demográficos: edad, sexo.
— Tipo de patología causante del dolor.
— Tipología de dolor: nociceptivo, neuropático y mixto.
— Opioides administrados y dosis.
— Intensidad del dolor medida mediante EVA.
— Efectos adversos con especial incidencia en: prevalencia de ansiedad/depresión.
— El estreñimiento se valoró aplicando el Índice de Función Intestinal (BFI).
— La calidad del sueño a través del Cuestionario de Oviedo del Sueño (COS) y el impacto de la ansiedad-depresión con el Cuestionario de Ansiedad/Depresión (HAD).
— La cognición se midió mediante la Escala SPMSQ de Pfeiffer (Short Portable Mental State Questionnaire). Es una prueba desarrollada por Pfeiffer en el año 1975, con 10 ítems que valoran varias funciones: orientación, memoria de evocación, concentración y cálculo. Muy breve, pero con una aceptable capacidad discriminatoria (Tabla I).

— Finalmente, se valoró el grado de satisfacción del paciente con el tratamiento mediante una escala Likert de 1 a 5, donde 1 significa “muy insatisfecho”, 2 “insatisfecho”, 3 “indiferente”, 4 “satisfecho” y 5 “muy satisfecho”.
En el grupo control se midieron las variables demográficas de edad y sexo, así como la calidad del sueño, el impacto de ansiedad y depresión, la prevalencia de estreñimiento y cognición, con los mismos test y escalas que en el grupo caso.
Análisis de datos
Se realizó un análisis descriptivo de las variables recogidas en el estudio; las variables cuantitativas se expresaron mediante mediana (rango intercuartílico) y las cualitativas mediante frecuencias absolutas y relativas. Posteriormente, con el propósito de contrastar los resultados entre los dos grupos de pacientes con respecto a las variables cuantitativas, se usó el test U de Mann-Whitney. Las variables categóricas mediante el test de la χ2. El software que se utilizó para el análisis estadístico fue IBM SPSS Statistics.
Resultados
El universo del estudio reclutó a un total de 318 pacientes, siendo el 55,97 % (178) de los participantes perteneciente al grupo caso de consumo de opioides.
En el grupo caso hubo un 65,2 % de mujeres frente al 71,5 % en el grupo control. En el primer grupo la edad media fue de 65,34 frente al 70,60 del segundo grupo (Tabla II).
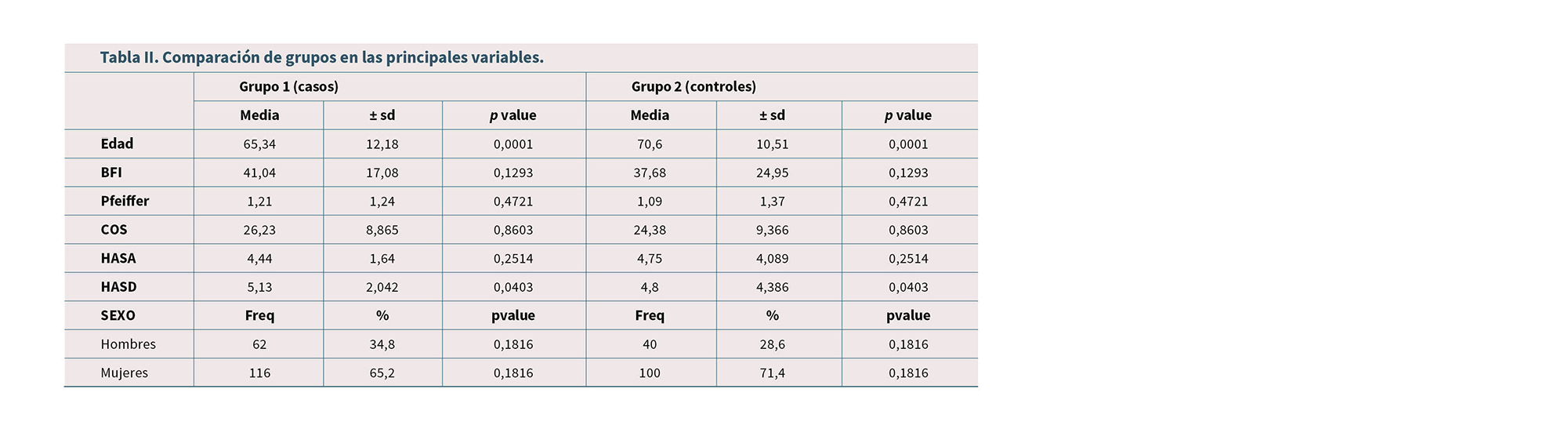
En el grupo de opioides, un 26 % consumía fármacos hipnosedantes o antidepresivos frente al 21 % del grupo control.
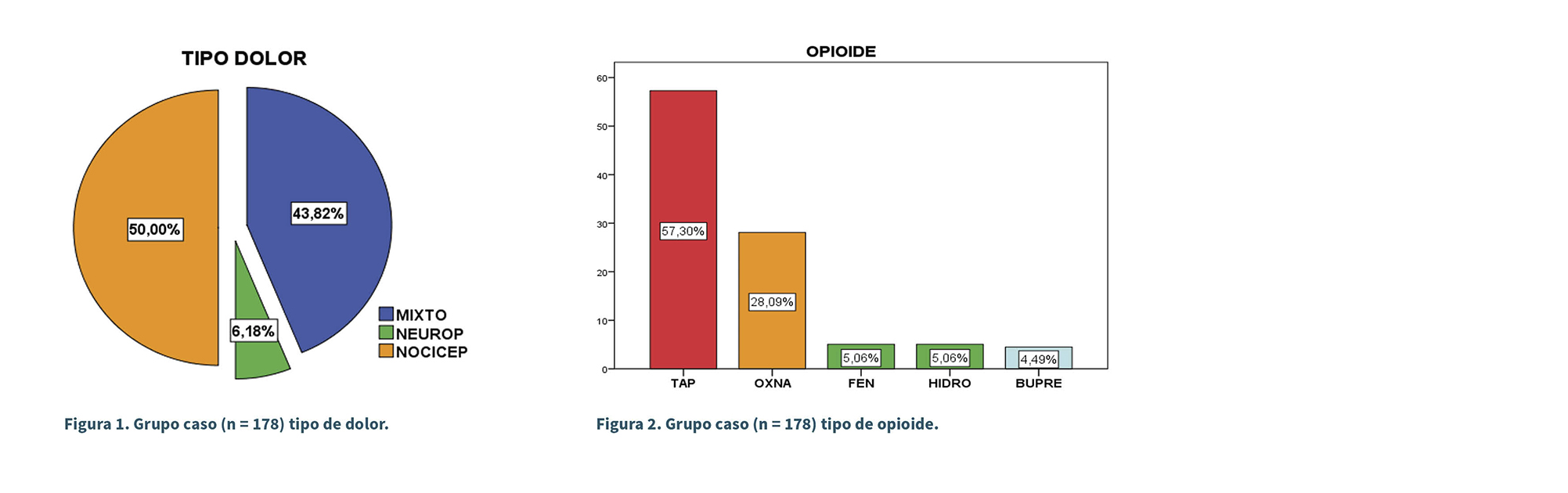
En la Figura 1: grupo caso (n = 178) tipo de dolor.
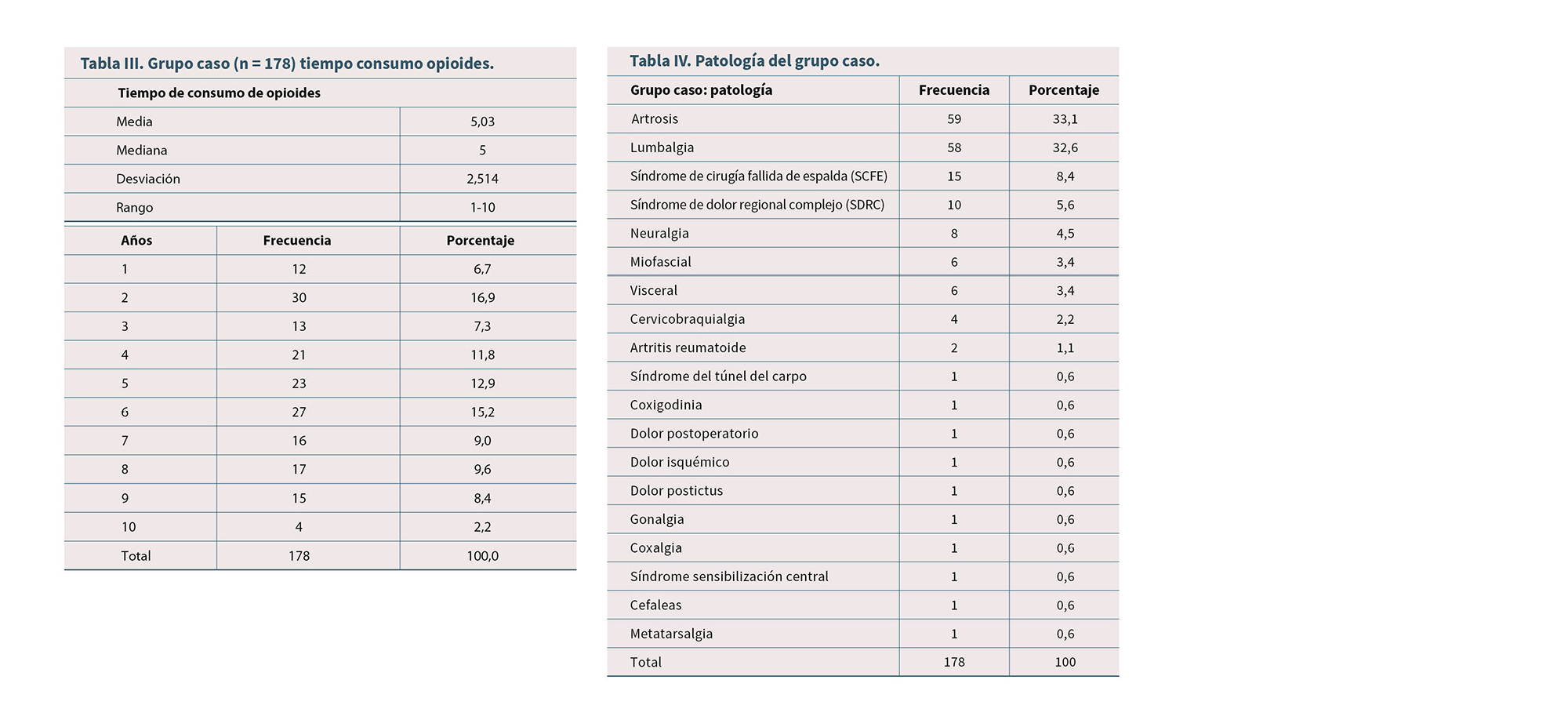
En la Figura 2: grupo caso (n = 178) tipo de opioide; el opioide más prescrito en el grupo caso fue tapentadol con un 57,30 %. El tiempo medio que consumieron opioides fue de 5,03 años, con un rango de 1 y 10 años.
En la Tabla III: grupo caso (n = 178) tiempo consumo opioides.
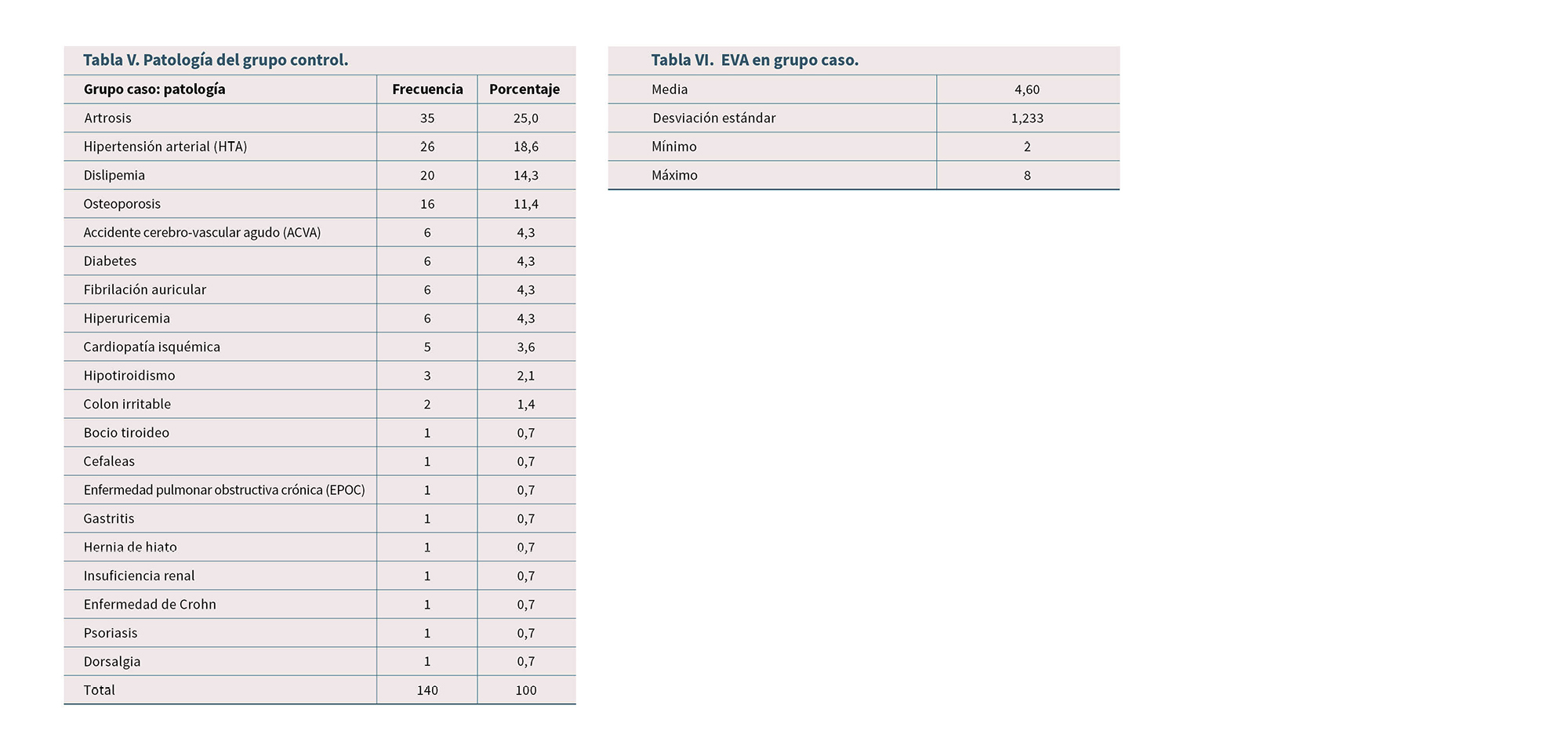
En la Tabla IV se recoge la patología del grupo caso y en la Tabla V se refleja la patología del grupo control.
El 51,13 % de los pacientes presenta EVA de 4 o menor, con media de 4,6 (Tabla VI).
En la Figura 3 se recogen los porcentajes de EVA de los pacientes del grupo caso.

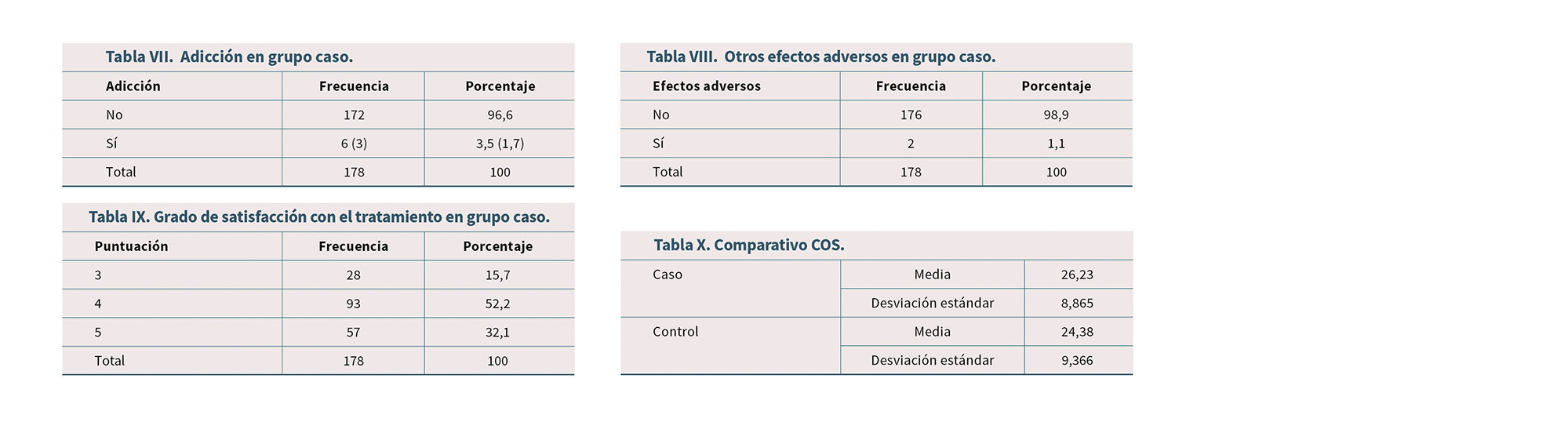
Bajo índice de efectos adversos (3,6 %, adicción. 5,6 % fracturas espontáneas). De los 6 pacientes que se etiquetó como adicción, 3 de ellos solo presentaba un consumo aberrante del opioide (Tabla VII); en la Tabla VIII se recogen los efectos adversos del grupo caso.
Alto grado de satisfacción con el tratamiento de opioides (85,2 %) (Tabla IX).
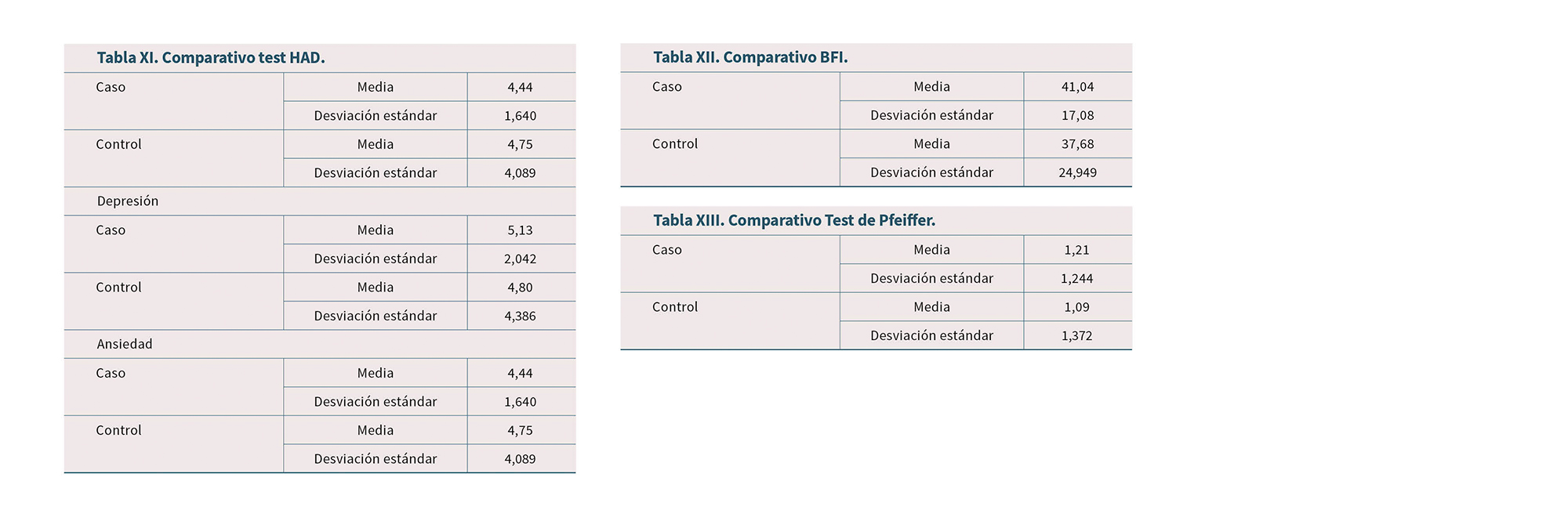
No hay diferencia significativa entre ambos grupos en el Cuestionario Oviedo del Sueño (Tabla X), ni en el test HAD (Tabla XI). Sí aparece una diferencia significativa con mayor índice de estreñimiento en el grupo caso medido con el BFI (Tabla XII).
Finalmente, no hay diferencia significativa entre ambos grupos al aplicar el Test de Pfeiffer (Tabla XIII).
Discusión
La cognición se encuentra dentro de las funciones cerebrales que han propiciado que el ser humano adquiera características evolutivamente desarrolladas para alcanzar la cima en la escala filogenética. El aumento de la esperanza de vida y, por tanto, el mayor envejecimiento de la población ha propiciado un gran interés por la ciencia médica en el estudio de la alteración que la edad puede provocar en las alteraciones cognitivas. Alteraciones que pueden presentar una gran diversidad de resultados, mostrando distinto grado de afectación en una amplia gama de funciones: velocidad de procesamiento, memoria, funciones visoperceptivas, visoespaciales y visoconstructivas, funciones lingüísticas, atención y funciones ejecutivas (19).
No obstante, aunque durante mucho tiempo se consideró que la niebla cerebral y la confusión mental formaban parte indeleble del proceso de envejecimiento, hoy sabemos, gracias a los últimos estudios, que incluso en la edad adulta se produce el fenómeno de neurogénesis.
Así es, a partir de los trabajos de Joseph Altman (20), se demostró la existencia de neurogénesis en algunas áreas del cerebro postnatal y adulto de la rata. Posteriormente se ha confirmado la existencia de esta neurogénesis también en el ser humano adulto, especialmente en el bulbo olfatorio y en el giro dentado del hipocampo, donde parece asentarse la memoria (21). De esta forma, durante la etapa postnatal y a lo largo de toda la vida, se ha demostrado que las nuevas neuronas no solo continúan generándose en el bulbo olfatorio, en el giro dentado, sino también posiblemente en algunas áreas corticales y en la sustancia negra. Aunque estos datos han sido cuestionados (22), sin embargo, hoy día es posible especificar que las áreas con mayor actividad neurogénica son la zona subventricular (ZSV) –delimitando los ventrículos– y la zona subgranular (ZSG) del giro dentado en el hipocampo. En estas dos zonas del cerebro adulto de los mamíferos existen células con actividad mitótica (23).
Actualmente se sabe que diversos neurotransmisores participan como factores que regulan la neurogénesis en el cerebro adulto. Entre los más estudiados se hallan el glutamato y monoaminas como la serotonina (5-HT), la noradrenalina y la dopamina. El glutamato se considera el neurotransmisor más importante para la función del encéfalo. Se sabe que regula la neurogénesis en el hipocampo de animales adultos (23).
Esta neurogénesis se debe a la plasticidad de nuestro sistema nervioso. Entendiendo por neuroplasticidad la capacidad que tiene el tejido neuronal de reorganizar y modificar los mecanismos biológicos y fisiológicos implicados en la comunicación intercelular, para adaptarse tras los estímulos recibidos. Esta característica implica modificaciones del tejido neural que incluye la regeneración axonal, la colateralización, la neurogénesis, la sinaptogénesis y la reorganización funcional (24).
La plasticidad cerebral es la adaptación funcional del sistema nervioso central para minimizar los efectos de las alteraciones estructurales o fisiológicas, independientemente de la causa originaria. Ello es posible gracias a la capacidad que tiene el sistema nervioso para experimentar cambios estructurales-funcionales detonados por influencias endógenas o exógenas, los cuales pueden ocurrir en cualquier momento de la vida. Estos cambios son un proceso dinámico que dura toda la vida.
El cerebro humano es plástico y se adapta a las circunstancias. Es capaz tanto de formar recuerdos de experiencias desagradables, como ocurre en los pacientes con dolor crónico, como de aprender programas motores complejos y estrategias conductuales. Asimismo, puede desarrollar trastornos psicopatológicos discapacitantes, pero también tiene la capacidad de recuperarse tras un traumatismo craneoencefálico o un accidente cerebrovascular (25).
Numerosas pruebas de carácter experimental demuestran que un estímulo doloroso de gran intensidad puede ser el preludio de una serie de alteraciones funcionales y morfológicas en el sistema nervioso central (SNC) que modifican la forma en que se gestiona y procesa la información sensorial periférica. La sensibilización central (SC) es un claro ejemplo de neuroplasticidad que va a provocar un incremento en la excitabilidad de las neuronas del SNC, especialmente en las neuronas medulares de segundo orden, encargadas de transmitir hacia el encéfalo información aferente que, procedente de los nociceptores periféricos, alcanza la médula espinal por medio del sistema aferente primario. En un estado de SC, las neuronas hiperexcitables se activan con mayor facilidad ante la entrada de señal nociceptiva periférica, tienden a amplificar la transmisión de información nociceptiva hacia centros superiores y pueden, de este modo, contribuir a la generación de estados clínicos de dolor patológico (26).
Aunque la cognición se ha descrito como la adquisición, procesamiento, almacenamiento y recuperación de información del cerebro, sí se considera la cognición como un término general que se puede usar para describir procesos neuropsicológicos integradores como imágenes mentales, resolución de problemas y percepción, y es pertinente a la experiencia de emoción y afecto. El dolor y la cognición compartirían una superposición inherente debido al hecho de que el dolor en sí tiene un componente cognitivo-evaluativo, que requiere aprendizaje, recuerdo de experiencias pasadas y toma de decisiones activa. Esto debe tenerse en cuenta al evaluar los efectos del dolor en la función cognitiva (27,28).
Sabemos que el dolor crónico genera alteraciones del sueño, así como cuadros depresivos, pero hoy también somos conocedores del gran impacto que el dolor puede tener sobre la cognición. El dolor crónico, por tanto, va a provocar una serie de alteraciones en la cognición. Al ser el dolor un proceso sensorial que exige atención, lógicamente los pacientes con dolor crónico han venido informando sobre la dificultad de atención (29,30).
Los trastornos de la memoria se han demostrado en una serie de enfermedades de las cuales el dolor crónico es un síntoma dominante, siendo particularmente frecuentes en pacientes con fibromialgia (31). También presentan una disminución de la velocidad de procesamiento de la información y capacidad psicomotriz, presentando los pacientes con dolor crónico un patrón común de alteración de la coordinación perceptivo-motora en el dolor crónico. De la misma forma, los pacientes con dolor crónico presentan alteraciones en las tareas cognitivas más complejas, como la planificación, la organización, el control de pensamientos conflictivos, el comportamiento dirigido a objetivos, el inicio de la acción y la evaluación de las consecuencias de las acciones (32).
Finalmente, en el estudio de Gwilym (33), se analizaron 16 pacientes con dolor unilateral de cadera, evaluándolos antes y nueve meses después de una artroplastia de cadera. El trabajo comparó el volumen de materia gris entre los pacientes con dolor musculoesquelético crónico y controles sanos, además de identificar cualquier cambio en el volumen tras el alivio del dolor. En los resultados se observaron diferencias significativas en el volumen de materia gris del cerebro entre controles sanos y pacientes con coxartrosis. Específicamente, las áreas del tálamo en pacientes con dolor crónico por artrosis exhibieron una disminución del volumen de materia gris. Además, cuando estos cambios preoperatorios se compararon con la morfología cerebral de los pacientes 9 meses después de la cirugía, se encontró que las áreas de volumen reducido de materia gris talámica se habían revertido a los niveles observados en los controles sanos. Llegando a la conclusión de que el volumen de materia gris disminuye dentro del tálamo izquierdo en presencia de dolor crónico y discapacidad en pacientes con artrosis de cadera.
Por tanto, en general, podemos afirmar que los estudios clínicos publicados hasta la fecha proporcionan una base sólida para la teoría de que la función cognitiva se ve afectada en pacientes con dolor crónico en comparación con los controles y con la población sana general.
Además del propio dolor, existen una serie de factores que pueden colaborar en las posibles alteraciones cognitivas de estos pacientes, tales como la falta de sueño o el consumo de determinados fármacos frecuentes como coadyuvantes en los pacientes con dolor crónico: antidepresivos duales y tricíclicos, fármacos anticonvulsivantes, anticolinérgicos, benzodiacepinas y, por supuesto, opioides.
Los antidepresivos son los fármacos psicótropos más ampliamente utilizados en el tratamiento del dolor. Los más usados en el tratamiento del dolor neuropático son los llamados duales y los tricíclicos, donde en algunas guías se les señala como fármacos de primera línea junto a los anticonvulsivantes. Tienen múltiples mecanismos de acción: inhiben la recaptación de monoaminas (serotonina y noradrenalina) desde la terminal presináptica. También producen bloqueo de canales (colinérgicos, adrenérgicos, histaminérgicos, y canales iónicos como el de sodio), inhiben los receptores NMDA (N-metil-D-aspartato) en el tracto espinotalámico y en el asta posterior de la médula espinal. La amitriptilina es la que más afinidad tiene por los receptores muscarínicos seguida de la clorimipramina, doxepina, imipramina, nortriptilina y desimipramina. Las aminas terciarias (amitriptilina, imipramina y clorimipramina) se asocian con mayor frecuencia a los eventos adversos (sedación extrema, hipotensión ortostática). Debe tenerse cuidado en pacientes geriátricos con enfermedad cardiovasculares, ya que se puede prolongar el intervalo QT (34).
Los anticonvulsivantes se emplean en el tratamiento del DN, sobre todo para los dolores lancinantes como en la neuralgia del trigémino, también en neuropatías diabética e isquémica, neuralgia postherpética, etc. A menudo en monoterapia o junto a los antidepresivos. El mecanismo de acción de los anticonvulsivantes bloquean los canales de Na+ disminuyendo o bloqueando las descargas repetitivas de alta frecuencia en la membrana axonal. Otros como la gabapentina modulan los neurotransmisores, aumentando los niveles del GABA (neurotransmisor inhibidor) y disminuyendo los de glutamato (neurotransmisor excitatorio). Del mismo modo, la pregabalina es un análogo del ácido γ-aminobutírico (GABA), relacionada estructuralmente con gabapentina. Se une a la subunidad auxiliar de los canales de calcio voltaje dependientes, reduciendo la entrada de calcio en las terminaciones nerviosas y, como consecuencia, disminuye la liberación de neurotransmisores excitadores. Es frecuente la aparición de mareos y somnolencia, presentes en aproximadamente el 30 % y el 23 % de los pacientes, respectivamente, y persistentes en el 31 % y el 45 % de los casos en los que se manifiestan. Además, se ha observado un incremento en el riesgo de lesiones accidentales entre los ancianos (35).
En una reciente revisión retrospectiva de historias clínicas de pacientes visitados entre 2015 y 2016 se encontró que 610 pacientes con una edad media de 81,1 años estaban en tratamiento con fármacos anticolinérgicos, presentando alteraciones cognitivas en un tercio de los pacientes analizados (36). En otra revisión, llega a las conclusiones de que estos fármacos se emplean de forma habitual en población anciana y si el consumo es prolongado, puede provocar un empeoramiento de la cognición a largo plazo, originando falsos diagnósticos de deterioro o incluso precipitando cuadros de demencia (37).
Durante los últimos 20 años se ha producido un importante incremento en el consumo de psicofármacos a nivel mundial, siendo las benzodiacepinas (BZD) uno de los fármacos más prescritos en la población. España ha sido por dos años consecutivos el país con mayor prescripción de este tipo de fármacos. Las BZD corresponden a una familia de fármacos que se caracterizan por ser depresores del sistema nervioso central, con efectos miorrelajantes (relajación muscular), anticonvulsivantes, ansiolíticos e hipnóticos. Su mecanismo de acción está asociado al complejo de receptores gamma-aminobutírico (GABA), los receptores inhibitorios del sistema nervioso central. Son fármacos ampliamente utilizados para el tratamiento de síntomas relacionados con la ansiedad y el insomnio. Entre los efectos adversos presenta deterioro cognitivo y demencia, aumento de la ansiedad, alto grado de dependencia y su uso se acompaña del riesgo de caídas (38).
Finalmente, tenemos el controvertido efecto de los opioides sobre la cognición. Aunque diversos estudios apuntan a que los opioides, en mayor o menor medida, producen alteraciones cognitivas en el paciente geriátrico (17,18), no existe unanimidad en la literatura científica publicada. Cierto es que los analgésicos opioides, en algunas ocasiones, producen somnolencia, cambios del estado de ánimo y embotamiento mental; no obstante, diversos autores sostienen que no existe una relación directa entre los trastornos cognitivos con un tratamiento reglado, correctamente pautado, indicado de forma adecuada y controlado de opioides. En este estudio, los pacientes tratados con metadona para deshabituación no mostraron un déficit generalizado de la cognición social, pero obtuvieron un menor cociente de inteligencia emocional-social y difirieron en la empatía medida mediante los juicios morales (17). Otro artículo propone que la combinación de opioides y cannabinoides podría ser efectiva para tratar el dolor sin aumentar los efectos adversos (39). En una revisión sistemática de 2019, la mayoría de los estudios no demostraron ningún efecto del uso de opioides en los dominios cognitivos, solo apreciándose en dosis altas (18). En este estudio piloto transversal se valoraron dos grupos, uno consumidor de opioides y otro libre de opioides durante 4 semanas, ambos grupos no difirieron en cognición, ansiedad, depresión, sueño y calidad de vida (40). En este estudio se evaluó el funcionamiento cognitivo en adultos anteriormente dependientes de opioides después de al menos 1 año de abstinencia, comprobando que el tratamiento de mantenimiento con opioides puede considerarse relativamente seguro con respecto a la disfunción cognitiva (41). En 2018 se publicó este artículo concluyendo que el consumo de opioides de prescripción no se asoció con un mayor riesgo de padecer Alzheimer (42). Finalmente, en una revisión narrativa de 2017 concluye que, si bien los estudios preliminares en animales sugieren efectos neurotóxicos de la exposición temprana al estrés, dolor, opioides y anestésicos, estos efectos parecen clínicamente menos relevantes en humanos (43).
Indudablemente, la epidemia de opioides en Estados Unidos ha venido a estigmatizar a este tipo de fármacos, y las erráticas políticas sanitarias de la CDC y la DEA han contribuido a disminuir de forma drástica la prescripción de opioides, provocando una ingente cantidad de pacientes con dolor crónico infratratado que han terminado abusando de otras terapias cuando no, buscando en mercados ilegales los opioides que se les negaba en las prescripciones legales y controlada. Muy a pesar de estas medidas de reducción de la prescripción legal de opioides, las muertes por sobredosis por fentanilo ilegal han seguido causando estragos en la sociedad norteamericana (6).
Dentro de esta crisis de opioides se han publicado artículos sobre alteración en la cognición en pacientes consumidores de opioides de forma recreativa, llegando a la conclusión de que estos pacientes mostraban deficiencias relativamente selectivas en las medidas de empatía cognitiva, con efectos dependientes de la dosis que sugieren posibles déficits inducidos por los opioides y la participación del sistema opioide en los procesos de empatía cognitiva (44).
No debemos olvidar que los pacientes con dolor crónico suelen ser pacientes polimedicados y, generalmente, en los fármacos concomitantes prescritos se suelen incorporar aquellos que, de una manera u otra, pueden aumentar o ser los responsables primigenios de las alteraciones en la cognición, en concreto, benzodiacepinas o antidepresivos. En Estados Unidos se ha comprobado que, en la mayoría de los casos de muerte por sobredosis, los opioides no eran los únicos responsables de esta, sino que, generalmente, se encontraban asociados, fundamentalmente, a benzodiacepinas o a alcohol (6).
Esta asociación de fármacos es importante conocerla y cuantificarla previamente si queremos no tener un sesgo importante a la hora de valorar el grado de cognición de pacientes consumidores de opioides. No olvidemos que las benzodiacepinas presentan hoy en día, en nuestro país, un elevado número de prescripciones, manteniéndose durante un excesivo tiempo el tratamiento, dosis elevadas y la formulación de acción prolongada en pacientes mayores (45).
Por eso, en nuestro estudio, sí hemos cuantificado el porcentaje de pacientes en ambos grupos que eran consumidores de fármacos que, de alguna manera, pudieran alterar la cognición, siendo el grupo de consumidores de opioides los que presentaban un mayor porcentaje de consumir otros psicofármacos (26 %) frente al grupo de pacientes sin opioides, cuyo porcentaje era inferior (21 %). No obstante, los resultados en el grado de cognición no mostraron variación estadísticamente significativa en ningún grupo, coincidiendo con lo publicado por otros autores, siempre y cuando la prescripción de opioides esté debidamente indicada y controlada (18).
No debemos olvidar la estrecha relación entre el sistema opioide y la cognición. Este sistema regula el procesamiento afectivo, incluyendo el dolor, el placer y la recompensa. Los receptores opioides se encuentran ampliamente distribuidos en el cerebro humano, abarcando también regiones “cognitivas” clave, como los lóbulos frontal y parietal. Por lo tanto, resulta plausible que los receptores mu puedan influir en funciones cognitivas superiores a través de la modulación de los circuitos de valoración y motivación (46).
Precisamente, en este estudio se realiza una revisión sistemática analizando la evidencia emergente sobre si la modulación aguda de los opioides en humanos sanos puede influir en la función cognitiva. Esta revisión apoya el papel del sistema opioide modulando algunos aspectos clave del control cognitivo y la toma de decisiones. Este estudio propone que el consumo de opioides influye en la toma de decisiones y en el control cognitivo al incrementar el valor subjetivo de la recompensa, mientras disminuye la excitación asociada a estímulos aversivos. En dosis altas, los opioides pueden afectar al desempeño de la función ejecutiva neuropsicológica, tareas que implican codificación y razonamiento lógico, mientras que, a dosis más bajas, los opioides pueden mejorar la función cognitiva, y la hipótesis de trabajo propuesta sugiere que estos efectos están impulsados por la reducción inducida por opioides de la excitación aversiva (46).
Conclusiones
Estimamos que el universo de pacientes que hemos recogido en este estudio (178 grupo caso y 140 grupo control) tiene suficiente significación estadística como para apuntar, de forma indiciaria, algunas conclusiones sobre el balance entre efectos adversos, entre ellos, por supuesto, los trastornos de cognición, y beneficios de los opioides a medio y largo plazo.
Los opioides nos aportan a medio y largo plazo:
— Un indudable beneficio en la reducción del dolor (51,13 % de los pacientes con EVA de 4 o menor, con media de 4,6).
— Alto grado de satisfacción con el tratamiento (85,2 %).
— Bajo índice de efectos adversos, ya hemos comentado que, aunque en principio se etiquetaron a 6 pacientes con comportamiento adictivo a los opioides, 3 solo presentaban un consumo aberrante de estos.
— Estreñimiento con diferencia estadísticamente significativa.
— Calidad del sueño sin diferencia significativa con el grupo control.
— Prevalencia ansiedad/depresión, similar en ambos grupos.
No hay diferencia significativa en la cognición, con respecto al grupo control, en los pacientes en tratamiento con opioides con una media de 5 años de duración. Este era el objetivo primario del estudio y con los resultados obtenidos podemos afirmar que los pacientes tratados con opioides potentes durante más de un año, no presentan más trastornos cognitivos que el grupo control, pacientes no consumidores de ningún tipo de opioides y con edad media similar.
Es posible la existencia de otras variables que puedan influir en el mayor o menor alteración cognitiva de estos pacientes, como el consumo concomitante de otro tipo de fármacos, tales como los hipnosedantes o antidepresivos. En nuestro estudio, el grupo de opioides un 36 % consumía fármacos hipnosedantes o antidepresivos frente al 34 % del grupo control.
Como ya se ha apuntado anteriormente, es cierto que el consumo de opioides a largo plazo es un tema muy controvertido, pero, en nuestra opinión, estimamos que, si hacemos una correcta elección del paciente y de las dosis de opioides y tomamos las precauciones necesarias, especialmente el control y seguimiento, conseguiremos evitar fracasos, falta de adherencia al tratamiento y efectos adversos indeseables, mejorando la calidad de vida de muchos pacientes.
En el seguimiento de los pacientes tratados con opioides, de la misma forma que se realiza control del posible abuso de opioides o control de estreñimiento con sus respectivos test o escalas, sería conveniente evaluar el posible deterioro cognitivo con la aplicación estandarizada del test de Pfeiffer.
bibliografía
1. Informe de Utilización de Medicamentos U/OPI/V1/13022017. Utilización de medicamentos opioides en España durante el periodo 2008-2015 [Internet]. Ministerio de Sanidad, Asuntos Sociales e Igualdad; 21 de febrero de 2017. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/observatorio/docs/opioides-2008-2015.pdf
2. Barómetro del dolor crónico en España 2022 [Internet]. Fundación Grünenthal; 2022. Disponible en: https://www.fundaciongrunenthal.es/fundacion/con-la-ciencia/barometro-dolor-cronico-espana-2022
3. Català E, Ferrándiz M, Lorente L, Landaluce Z, Genové M. Uso de opioides en el tratamiento del dolor crónico no oncológico. Recomendaciones basadas en las guías de práctica clínica. Rev Esp Anestesiol Reanim. 2011;58(5):283-9. DOI: 10.1016/S0034-9356(11)70063-9.
4. Bonnie RJ, Kesselheim AS, Clark DJ. Both Urgency and Balance Needed in Addressing Opioid Epidemic: A Report From the National Academies of Sciences, Engineering, and Medicine. JAMA. 2017;318(5):423-4. DOI: 10.1001/jama.2017.10046.
5. Kissin I. Long-term opioid treatment of chronic nonmalignant pain: unproven efficacy and neglected safety? J Pain Res. 2013;6:513-29.
6. Rose ME. Are Prescription Opioids Driving the Opioid Crisis? Assumptions vs Facts. Pain Med. 2018;19(4):793-807. DOI: 10.1093/pm/pnx048.
7. Tormo J, Marín L, González M, Ruiz M, Robles J, Vivar M. Prescripción de opioides mayores en pacientes con dolor no oncológico: descripción de sus características en una zona de salud de atención primaria. Rev Soc Esp Dolor. 2017;24(1):19-26. DOI: 10.20986/resed.2016.3471/2016. DOI: 10.20986/resed.2016.3471/2016.
8. Reid MC, Henderson CR Jr, Papaleontiou M, Amanfo L, Olkhovskaya Y, Moore AA, et al. Characteristics of older adults receiving opioids in primary care: treatment duration and outcomes. Pain Med. 2010;11(7):1063-71. DOI: 10.1111/j.1526-4637.2010.00883.x.
9. Fredheim OMS, Borchgrevink PC, Mahic M, Skurtveit S. A pharmacoepidemiological cohort study of subjects starting strong opioids for nonmalignant pain: a study from the Norwegian Prescription Database. Pain. 2013;154(11):2487-93. DOI: 10.1016/j.pain.2013.07.033.
10. Krčevski Škvarč N, Morlion B, Vowles KE, Bannister K, Buchsner E, Casale R, et al. European clinical practice recommendations on opioids for chronic noncancer pain - Part 2: Special situations. Eur J Pain. 2021;25(5):969-85. DOI: 10.1002/ejp.1744.
11. Raz N, Rodrigue KM, Kennedy KM, Dahle C, Head D, Acker JD. Differential age-related changes in the regional metencephalic volumes in humans: a 5-year follow-up. Neurosci Lett. 2003;349(3):163-6. DOI: 10.1016/S0304-3940(03)00820-6.
12. Rosselli M, Jurado M. Evaluación neuropsicológica de la demencia. Rev Neuropsicología, Neuropsiquiatría y Neurociencias. 2012;12(1):99-1.
13. American Geriatrics Society Panel on Pharmacological Management of Persistent Pain in Older Persons. Pharmacological management of persistent pain in older persons. J Am Geriatr Soc. 2009;57(8):1331-46. DOI: 10.1111/j.1532-5415.2009.02376.x.
14. Mencias A, Rodríguez J. Consideraciones sobre el empleo de opioides en el dolor crónico del paciente geriátrico. Rev Soc Esp Dolor. 2008;15(7):463-74.
15. Wollman SC, Hauson AO, Hall MG, Connors EJ, Allen KE, Stern MJ, et al. Neuropsychological functioning in opioid use disorder: A research synthesis and meta-analysis. Am J Drug Alcohol Abuse. 2019;45(1):11-25. DOI: 10.1080/00952990.2018.1517262.
16. Barber JB, Gibson SJ. Treatment of chronic non-malignant pain in the elderly. Safety considerations. Drug safety. 2009;32(6):457-74. DOI: 10.2165/00002018-200932060-00003.
17. Martin-Contero MC, Secades-Villa R, Tirapu-Ustarroz J. Cognicion social en adictos a opioides. Rev Neurol. 2012;55(12):705-12. DOI: 10.33588/rn.5512.2012553.
18. Pask S, Dell’Olio M, Murtagh FEM, Boland JW. The Effects of Opioids on Cognition in Older Adults With Cancer and Chronic Noncancer Pain: A Systematic Review. J Pain Symptom Manage. 2020;59(4):871-893.e1. DOI: 10.1016/j.jpainsymman.2019.10.022.
19. Nieto Barco MA, Barroso Ribal JD, Correia Delgado RI, Hess Medler S, Montón Álvarez I. Cambios cognitivos en el envejecimiento normal: un estudio de seguimiento. Proyectos de Investigación Científica, Desarrollo e Innovación Tecnológica [Proyecto 59/2011. Proyecto de investigación]. Ministerio de Sanidad, Servicios Sociales e Igualdad. Dirección General del Instituto de Mayores y Servicios Sociales (IMSERSO).
20. Bayer SA, Altman J, Russo RJ, Zhang X. Timetables of neurogenesis in the human brain based on experimentally determined patterns in the rat. Neurotoxicology. 1993;14(1):83-144.
21. Boldrini M, Fulmore CA, Tartt AN, Simeon LR, Pavlova I, Poposka V, et al. Human Hippocampal Neurogenesis Persists throughout Aging. Cell Stem Cell. 2018;22(4):589-599.e5. DOI: 10.1016/j.stem.2018.03.015.
22. Sorrells SF, Paredes MF, Cebrian-Silla A, Sandoval K, Qi D, Kelley KW, et al. Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Nature. 2018;555(7696):377-81. DOI: 10.1038/nature25975.
23. Bergmann O, Frisén J. Neuroscience. Why adults need new brain cells. Science. 2013;340(6133):695-6. DOI: 10.1126/science.1237976.
24. Hötting K, Röder B. Beneficial effects of physical exercise on neuroplasticity and cognition. Neurosci Biobehav Rev. 2013;37(9 Pt B):2243-57. DOI: 10.1016/j.neubiorev.2013.04.005.
25. de Oliveira RMW. Neuroplasticity. J Chem Neuroanat. 2020;108:101822. DOI: 10.1016/j.jchemneu.2020.101822.
26. Akinci A, Al Shaker M, Chang MH, Cheung CW, Danilov A, José Dueñas H, et al. Predictive factors and clinical biomarkers for treatment in patients with chronic pain caused by osteoarthritis with a central sensitisation component. Int J Clin Pract. 2016;70(1):31-44. DOI: 10.1111/ijcp.12749.
27. Lawlor PG. El panorama de la disfunción cognitiva relacionada con los opioides en pacientes con cáncer: una evaluación crítica de la literatura. Cáncer. 2002;94:1836-53.
28. Moriarty O, McGuire BE, Finn DP. The effect of pain on cognitive function: a review of clinical and preclinical research. Prog Neurobiol. 2011;93(3):385-404. DOI: 10.1016/j.pneurobio.2011.01.002.
29. Velázquez I, Muñoz M, Sánchez M, Zenner A y Velázquez L. Trastornos del sueño e incidencia de ansiedad y depresión en pacientes con dolor crónico no maligno tratados con opioides potentes. Rev Soc Esp Dolor. 2012;19(2):49-58.
30. Gálvez R, Marsal C, Vidal J, Ruiz M, Rejas J. El dolor neuropático como causa de ansiedad, depresión y trastornos del sueño en condiciones de práctica médica habitual: resultados del estudio DONEGA. Rev Soc Esp Dolor. 2006;13(2):81-95.
31. Glass JM. Review of cognitive dysfunction in fibromyalgia: a convergence on working memory and attentional control impairments. Rheum Dis Clin North Am. 2009;35(2):299-311.
32. Maihöfner C, DeCol R. Decreased perceptual learning ability in complex regional pain syndrome. Eur J Pain. 2007;11(8):903-9.
33. Gwilym SE, Filippini N, Douaud G, Carr AJ, Tracey I. Thalamic atrophy associated with painful osteoarthritis of the hip is reversible after arthroplasty: a longitudinal voxel-based morphometric study. Arthritis Rheum. 2010;62(10):2930-40.
34. Saarto T, Wiffen PJ. Antidepressants for neuropathic pain. Cochrane Database Systemic Reviews. 2005;20:1-75.
35. Backonja M, Beydoun A, Edwards KR, Schwartz SL, Fonseca V, Hes M, et al. Gabapentin for the symptomatic treatment of painful neuropathy in patients with diabetes mellitus: a randomized controlled trial. JAMA. 1998;280(21):1831-6.
36. López-Matons N, Conill Badell D, Obrero Cusidó G, Gil Saladié D, Padrós Selma J, Martin-López A. Anticholinergic drugs and cognitive impairment in the elderly. Med Clin (Barc). 2018;151(4):141-4.
37. López-Álvarez J, Zea Sevilla MA, Agüera Ortiz L, Fernández Blázquez MÁ, Valentí Soler M, Martínez-Martín P. Efecto de los fármacos anticolinérgicos en el rendimiento cognitivo de las personas mayores. Rev Psiquiatr Salud Ment. 2015;8(1):35-43.
38. Bartlett G, Abrahamowicz M, Grad R, Sylvestre MP, Tamblyn R. Association between risk factors for injurious falls and new benzodiazepine prescribing in elderly persons. BMC Fam Pract. 2009;10:1.
39. Minervini V, France CP. Effects of opioid/cannabinoid mixtures on impulsivity and memory in rhesus monkeys. Behav Pharmacol. 2020;31(2&3):233-48.
40. Diasso PDK, Sjøgren P, Højsted J, Nielsen SD, Main KM, Kurita GP. Patient reported outcomes and neuropsychological testing in patients with chronic non-cancer pain in long-term opioid therapy: a pilot study. Scand J Pain. 2019;19(3):533-543.
41. Schmidt P, Haberthür A, Soyka M. Cognitive Functioning in Formerly Opioid-Dependent Adults after At Least 1 Year of Abstinence: A Naturalistic Study. Eur Addict Res. 2017;23(6):269-75. DOI: 10.1159/000485032.
42. Taipale H, Hamina A, Lampela P, Tanskanen A, Tiihonen J, Karttunen N, et al. Is Alzheimer’s Disease Associated with Previous Opioid Use? Pain Med. 2018;19(11):2115-21. DOI: 10.1093/pm/pnx210.
43. van den Bosch GE, Dijk MV, Tibboel D, de Graaff JC. Long-term Effects of Early Exposure to Stress, Pain, Opioids and Anaesthetics on Pain Sensitivity and Neurocognition. Curr Pharm Des. 2017;23(38):5879-86. DOI: 10.2174/1381612823666170926150259.
44. Kroll SL, Nikolic E, Bieri F, Soyka M, Baumgartner MR, Quednow BB. Cognitive and socio-cognitive functioning of chronic non-medical prescription opioid users. Psychopharmacology (Berl). 2018;235(12):3451-64. DOI: 10.1007/s00213-018-5060-z.
45. Jones CM, McAninch JK. Emergency department visits and overdose deaths from combined use of opioids and benzodiazepines. Am J Prev Med. 2015;49(4):493-501. DOI: 10.1016/j.amepre.2015.03.040.
46. van Steenbergen H, Eikemo M, Leknes S. The role of the opioid system in decision making and cognitive control: A review. Cogn Affect Behav Neurosci. 2019;19(3):435-58. DOI: 10.3758/s13415-019-00710-6.