Introducción
La osteoartritis (OA) es una enfermedad articular degenerativa que afecta con frecuencia a las rodillas por el peso que soportan (1). En España, casi 5 millones de adultos han sido diagnosticados con OA de rodilla (2). La OA es considerada como una de las principales causas de discapacidad funcional (3). El paciente con OA está sufriendo no solo por el dolor persistente, rigidez y movilidad limitada, sino también porque afecta directamente a su calidad de vida (3). La OA también tiene un gran coste económico, aproximadamente el 0,5 % del producto interior bruto (4).
La OA presenta una gran complejidad de varios factores biológicos: alteraciones genéticas, hormonales y el envejecimiento (5). El término “condrosenescencia” se utiliza para describir el deterioro dependiente de la edad de la función de los condrocitos. Los enfoques terapéuticos de la OA son limitados debido a su compleja fisiopatología. De acuerdo con la Guía de la Sociedad Internacional de artritis (OARSI; https://oarsi.org/) y recomendaciones para el manejo de OA, se ha establecido un conjunto básico de terapias basadas en evidencia que han permitido reducir el número de pacientes que precisan artroplastia de rodilla (6). Estas modalidades incluyen ayudas no farmacológicas como la educación y la concienciación del paciente, el ejercicio físico y la rehabilitación. Las modalidades farmacológicas van desde la prescripción de analgésicos menores e incluso de opioides. Los antiinflamatorios no esteroideos (AINE) son los agentes más prescritos para OA (7), a pesar de que a largo plazo se asocian con efectos adversos graves. Las inyecciones de ácido hialurónico (AH) se utilizan clínicamente para mitigar las funciones disminuidas del AH endógeno despolimerizado de pacientes con OA (8). Aunque el AH exógeno no restaura y reemplaza todas las funciones apropiadas del AH endógeno del líquido sinovial, puede inducir un alivio satisfactorio del dolor a través de varios mecanismos (9). Estos mecanismos incluyen síntesis de proteoglicanos y/o glucosamina, efecto antiinflamatorio y mantenimiento de la viscoelasticidad (9). Algunos estudios reportan un efecto beneficioso general, mientras que otros informan que solo hay un pequeño beneficio (10). En el tratamiento mínimamente invasivo de la OA de rodilla, el plasma rico en plaquetas y el ácido hialurónico proporcionan beneficios en el dolor y la funcionalidad.
Ácido hialurónico para el tratamiento de la OA
El AH se administra en pacientes con OA a través de dos formas, administración oral o inyección articular (11). Hay varias preparaciones de AH inyectable. Este es uno de los principales sesgos en la mayoría de las publicaciones existentes, y es el principal motivo por el que no hay evidencia incluso en artículos de investigación bien diseñados.
Para nuestro estudio usamos un hidrogel estéril, no pirogénico, fabricado con HYADD® 4 (hexadecilamida de la sal sódica de ácido hialurónico, altamente purificado) obtenido por fermentación bacteriana, indicado en el tratamiento del dolor artrítico de las articulaciones, en el tratamiento conservador de la lesión meniscal de rodilla y para mejorar la movilidad articular mediante el aumento de la viscoelasticidad del líquido sinovial (12), cuyo nombre comercial es Hymovis® de laboratorios Fidia®.
Cuando el AH es inyectado localmente, a diferencia del tratamiento oral, la molécula de AH completa se introduce en la cavidad articular intrasinovial en el líquido sinovial de la articulación afectada, proporcionando diferentes mecanismos para el alivio de los síntomas (13). Estos incluyen mejorar la síntesis de proteínas de la matriz extracelular, alterar los mediadores inflamatorios para reducir su degradación, reducir la motilidad de los linfocitos, y mantener el grosor del cartílago, el área y la suavidad superficial. El tratamiento con AH inyectado es un tratamiento eficaz para la OA basado en sus efectos sobre el dolor, la función y la evaluación global del paciente. En términos de seguridad, también se ha demostrado que no hay efectos secundarios negativos (14). La conclusión del metanálisis de 26 ensayos clínicos indicó que la inyección de AH sería considerada como la mejor línea de tratamiento conservador para la
OA de cadera con alivio sustancial del dolor y mejora de la función (15).
Factores de crecimiento (PRP) para el tratamiento de la OA
El agente más comúnmente relacionado con el AH en el tratamiento de la OA es el plasma rico en plaquetas (PRP), que recientemente se ha demostrado capaz de reclutar células madre mesenquimales adultas endógenas y permitir la regeneración de tejido de novo (16). El PRP rico en factores de crecimiento es una tecnología biomédica dirigida a estimular la regeneración tisular mediante la concentración y aplicación de los factores de crecimiento y otras proteínas presentes en el plasma sanguíneo. Son un conjunto de proteínas presentes en el plasma y en las plaquetas de la sangre que desempeñan una función esencial en los procesos de reparación y regeneración de los tejidos, ya que desencadenan efectos biológicos, como la proliferación y diferenciación celular, la generación de vasos sanguíneos (angiogénesis) y la migración de las células a los lugares donde es necesario que se produzca la regeneración (quimiotaxis). Se puede considerar que los factores de crecimiento del PRP son los mensajes que utiliza el cuerpo para comunicar a las células cuándo deben crecer, diferenciarse o moverse o determinar fenómenos de apoptosis celular para reparar una lesión.
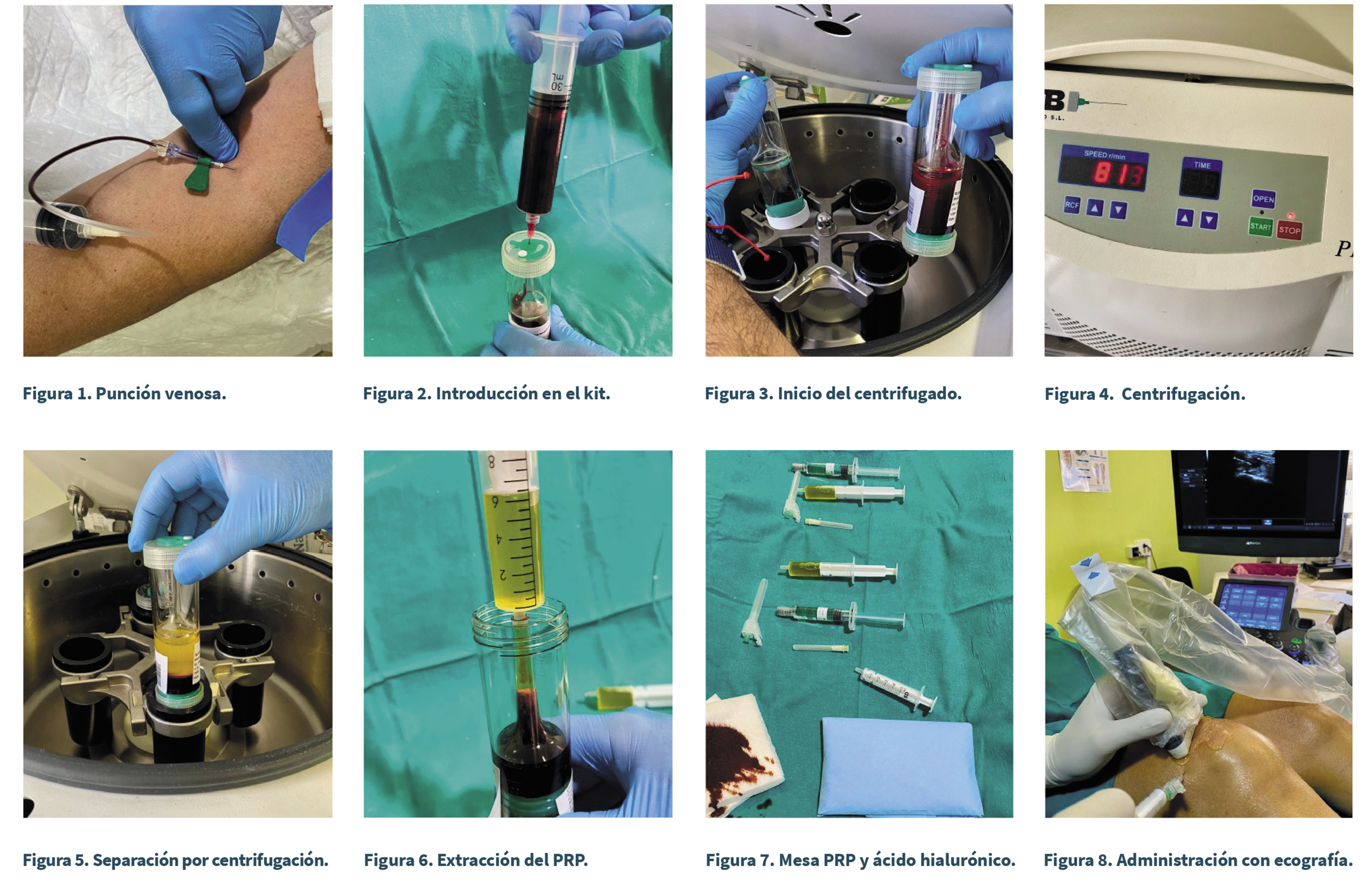
Para obtener el PRP se realiza una extracción de 20 ml de sangre del paciente; se centrifuga para separar las plaquetas del resto de las células. Por cada 20 ml se obtienen 4 ml de PRP. Existen en el mercado numerosos sistemas de centrifugación, cada uno con unos parámetros de centrifugado específicos y que utilizan unos volúmenes de sangre específicos (Figuras 1 a 8).
Con la ingeniería del tejido del cartílago, los condrocitos se pueden encapsular en redes de hidrogel. Un ensayo clínico comparó la inyección de AH con la inyección de plasma rico en plaquetas (PRP) y se ha demostrado que el AH es superior al PRP en pacientes con OA de cadera sintomática en términos de alivio del dolor y mejora funcional (15).
La administración intraarticular en la condroplastia de rodilla por OA de PRP o de AH ha demostrado ser útil para reducir el dolor y mejorar la capacidad funcional, no obstante, la evidencia científica aún es escasa para asegurar y describir detalladamente si la inyección de PRP proporciona mejor analgesia y capacidad funcional que el AH. En un metanálisis (17) se concluye que la inyección de PRP proporciona mejor analgesia a largo tiempo y mejor capacidad funcional que la inyección de AH, aunque en un ensayo clínico (18) no se encuentran diferencias al compararlos entre sí respecto a la mejoría de la capacidad funcional.
Recientemente ha cobrado interés la combinación de PRP y AH en la misma inyección intraarticular para la OA de rodilla. En otro metanálisis (19) se concluye que el efecto sinérgico de ambos, en comparación con PRP solo, ofrece mejor capacidad funcional a los 12 meses y mejor analgesia a los 6 meses. Faltan estudios que aporten mayor evidencia científica del efecto sinérgico de combinar PRP más AH.
Objetivos
Comparar la eficacia terapéutica de PRP autólogo, hexadecilamida de hialuronato sódico (Hymovis®), o una combinación de ambos (PRP + AH) en osteoartrosis de rodilla (OA).
Diseño del estudio
Estudio clínico aleatorizado, unicéntrico, doble ciego, comparativo en condiciones clínicas reales en el periodo comprendido entre el 10 de enero de 2019 y el 31 de marzo de 2021.
Pacientes y métodos
Este estudio fue aprobado por el Comité de Ética del Hospital Universitario Puerta del Mar de Cádiz. Los pacientes que cumplían los criterios de inclusión y aceptaron formar parte del estudio firmaron el consentimiento informado y fueron incluidos en el estudio.
Los criterios de inclusión fueron pacientes que sufrían OA de rodilla (diagnosticados por métodos clínicos y radiológicos y con una intensidad de dolor al inicio > 40 en una escala analógica visual (VAS) de 100 mm.
Los criterios de exclusión fueron: cirugía previa, presencia de deformidades excesivas, artritis inflamatoria de rodilla, trastornos infecciosos, cardiovasculares, del sistema inmunitario, oncológicos o embarazo.
Se reclutaron 109 pacientes con edades entre 35 y 81 años de los cuales 101 (62 mujeres y 47 hombres) acabaron el seguimiento durante 1 año, siendo tratados de forma ambulatoria.
Para la elaboración del PRP usamos el kit pro prp kit 30 ml de Goodmorning bio S.L.
El método de elaboración del PRP descrito en las instrucciones de la compañía fue el siguiente:
1. Extraer 3 ml de anticoagulante (citrato sódico) en la jeringa de 30 ml, con aguja 19 G.
2. Con la aguja epicraneal (palomilla), extraer sangre del paciente en la misma jeringa hasta completar los 30 ml (Figura 1).
3. Inyectar el contenido obtenido de la jeringa de 30 ml en el tubo PRP P30A, atravesando la goma verde del mismo, con la aguja 19 G, tocando la punta de la aguja con el borde interno del tubo para evitar hemólisis y la formación de burbujas (Figura 2).
4. Colocar en la centrifugadora el tubo PRP P30A y un contrapeso en el vaso opuesto (poner un contrapeso rellenando de suero fisiológico otro PRP P30A) (Figura 3).
5. Centrifugar a 2800 RPM durante 5 minutos (Figura 4).
6. Una vez finalizado el centrifugado, abrir la tapa y retirar suavemente el tubo PRP P30A de la centrífuga, sosteniéndolo verticalmente, sin agitarlo.
Obtención de PPP y PRP:
7. Desenroscar la tapa inferior del tubo PRP P30A.
8. Adaptar cuidadosamente el controlador o “pusher”.
9. Girar la parte inferior del “pusher” en sentido de las agujas del reloj hasta que el plasma llegue al borde superior del tubo.
10. Abrir el tapón verde de la parte superior del tubo y conecte la jeringa de 20 ml (jeringa colectora de PPP) mediante presión.
11. Girar el “pusher” hasta que la capa de glóbulos blancos alcance la marca de 6 ml del tubo (Figura 5).
12. Retirar la jeringa de 20 ml y conectar mediante presión la jeringa de 10 ml (jeringa colectora de PRP) en la parte superior y girar el controlador hasta que la capa de leucocitos alcance el borde superior del tubo.
13. Retirar la jeringa con el PRP (6 ml) (Figura 6).
14. Preparar la mesa con jeringas, agujas, prp y AH (Figura 7).
La infiltración siempre se realizó con control ecográfico realizando punción en plano desde lateral, visualizando en todo momento la introducción de la aguja y la localización intrarticular de la punta de esta a nivel del receso suprapatelar (Figura 8).
Los grupos fueron homogéneos en características demográficas. Los criterios de exclusión fueron: cirugía previa, presencia de deformidades excesivas, artritis inflamatoria de rodilla, trastornos infecciosos, cardiovasculares, del sistema inmunitario, oncológicos o embarazo. La medida de resultados del objetivo primario fue un cambio en la intensidad del dolor evaluado por el VAS a los 2, 6 y 12 meses después del tratamiento. Las medidas secundarias de resultados fueron el test Western Ontario McMaster Universities Osteoarthritis Index (WOMAC), Womac rigidez (0-10) Womac capacidad funcional
(0-68). Para el cálculo estadístico se utilizó el programa SPSS para Windows, versión 19.0. El objetivo era comparar las variables cuantitativas de tendencia central (medias y desviación típica), de cada una de ellas en el tiempo y entre sí. Los test estadísticos utilizados fueron la t de student y la ANOVA, considerando significativo un valor de p < 0,05.
Las evaluaciones fueron realizadas de forma doble ciego. Los pacientes no conocían el grupo al que pertenecían, tampoco lo conocía el evaluador que siempre fue el mismo, también fue siempre el mismo médico el que practicó la inyección y el técnico que preparó el PRP.
Resultados
Un total de 101 pacientes asignados aleatoriamente a 3 grupos para recibir 2 inyecciones bisemanales de AH (35 pacientes), PRP (32 pacientes) o PRP + AH (34 pacientes), 8 de ellos fueron excluidos por causas ajenas relacionadas con la infiltración con los fármacos objetivo del estudio. Todos los pacientes fueron homogéneos en sus características demográficas, sin encontrar diferencias significativas (p > 0,05) y por tanto comparables.
Todos los pacientes en los 3 grupos (AH, PRP, PRP + AH) mejoran el VAS, WOMAC-r y WOMAC-cp, desde el inicio del seguimiento hasta a los 6 meses de forma significativa (p < 0,05), no obstante, comienzan a empeorar en VAS y WOMAC-r desde los 6 a los 12 meses de forma significativa (p < 0,05). Y por último destaca que, entre los 6 y 12 meses, el WOMAC-cf en los grupos AH y PRP empeora y en el grupo PRP + AH mejoraron, aunque no de forma significativa (p > 0,05) (Tablas I y II).
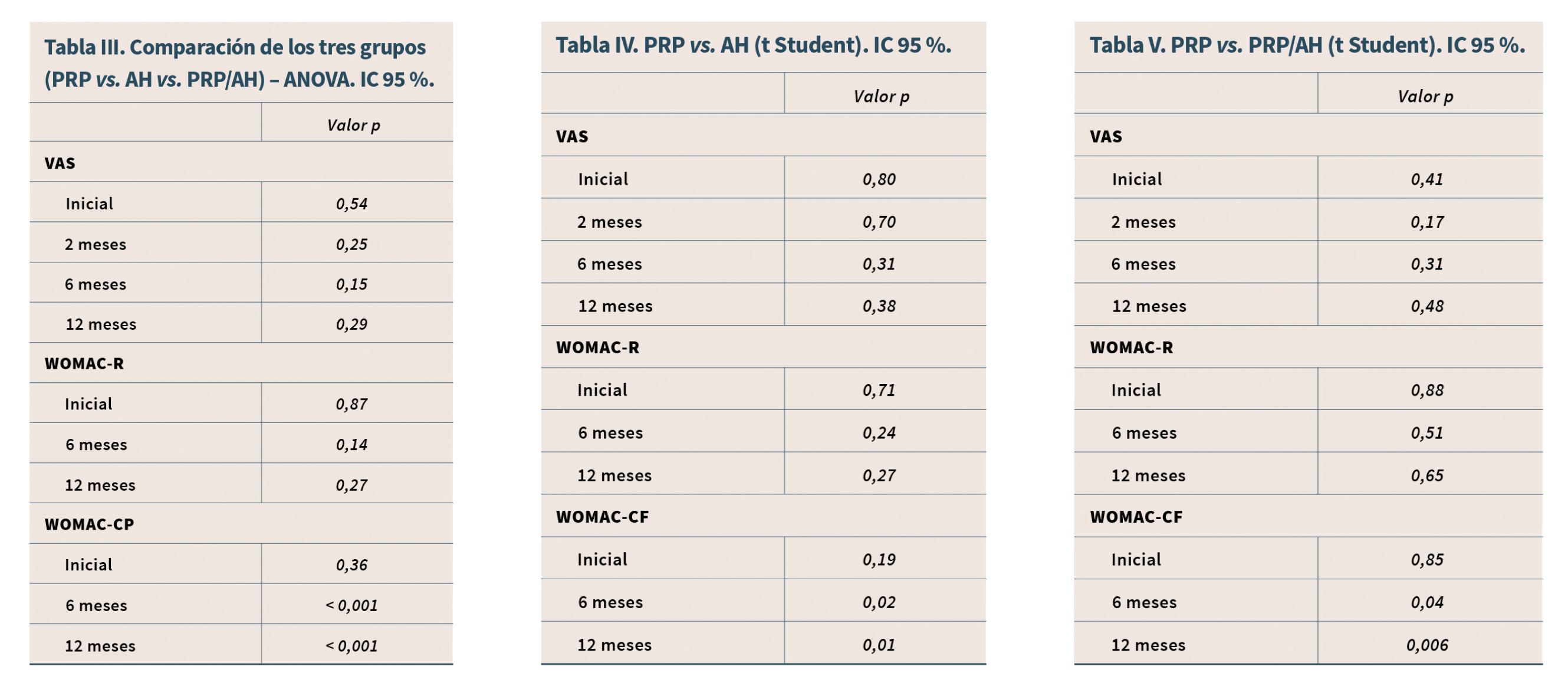
Al comparar los grupos entre sí, PRP vs. AH y PRP vs. AH + PRP, no existen diferencias en VAS y WOMAC-r (Tabla III). No obstante la combinación de PRP + AH es mejor que AH solo o PRP solo en WOMAC-cf a los 6 y 12 meses de forma significativa (p < 0,05) (Tablas IV y V).
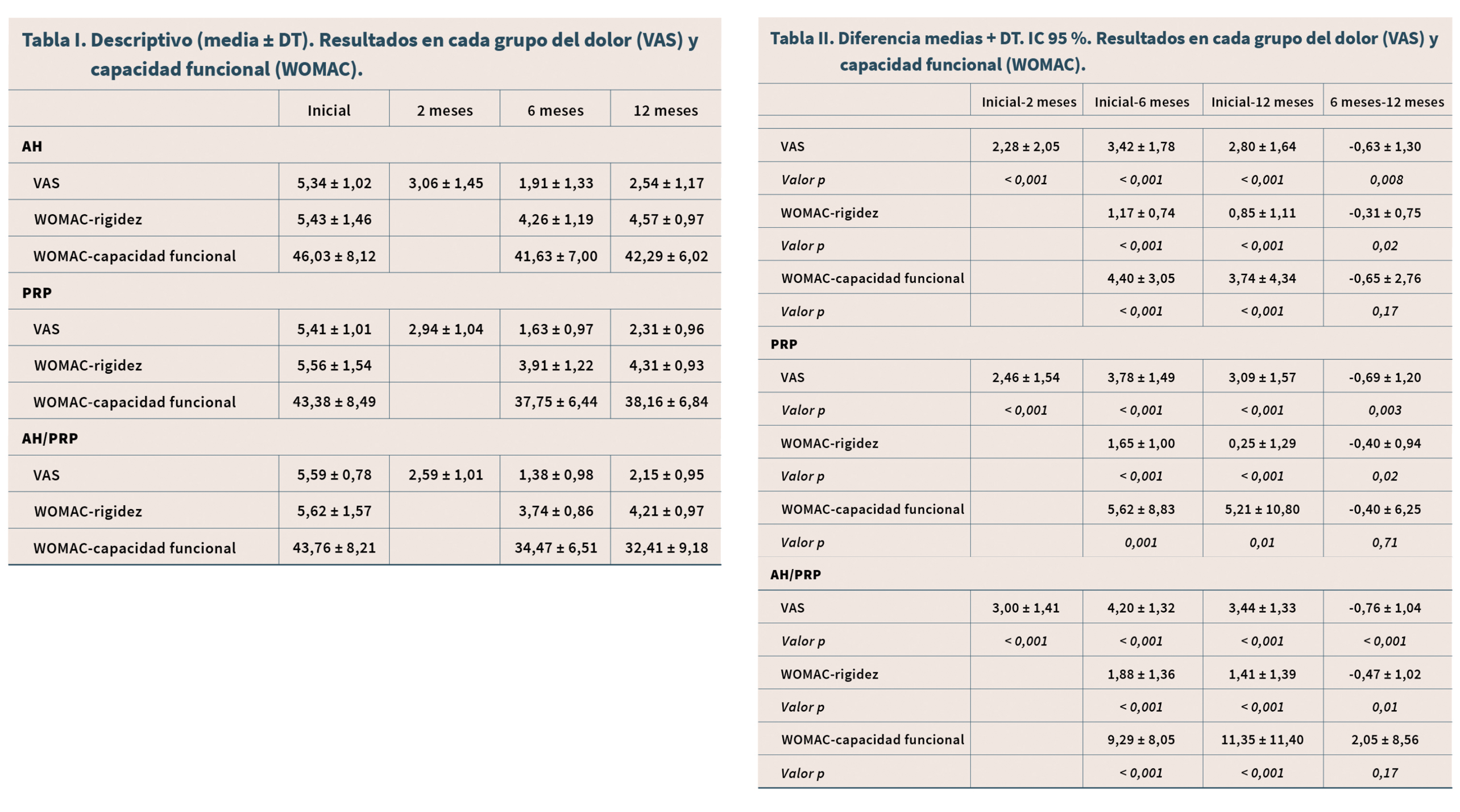
Como se aprecia en la Tabla I, se lograron mejoras significativas en la reducción del dolor y la mejora de la calidad de vida y la recuperación funcional.
En la Tabla IV comparamos los resultados entre los grupos PRP y AH. No Encontramos diferencias significativas en VAS y WOMAC-r. Se observa que los resultados siguen siendo buenos, aunque PRP mejor que AH en WOMAC-cf a los 6 y 12 meses de forma significativa.
En la Tabla IV comparamos la diferencia estadística entre el grupo PRP y AH.
En la Tabla IV comparamos los resultados entre los grupos PRP y PRP/AH.
Los resultados muestran que no hay diferencias significativas entre PRP+AH vs. PRP, en VAS y WOMAC-r, y que PRP fue mejor que AH en WOMAC-cf a los 6 y 12 meses de forma significativa.
En la Tabla V comparamos los 3 grupos entre sí, encontrando diferencias entre grupos en WOMAc-cf a los 6 y 12 meses de forma significativa.
La funcionalidad es superior con la asociación PRP y ácido hialurónico a los 12 meses de seguimiento que cada uno de ellos.
Discusión
Este trabajo tiene como objetivo mostrar los resultados retrospectivos de nuestra práctica clínica en el tratamiento de la OA de rodilla con la inyección intrarticular de AH, PRP o la mezcla de ambos. La mayoría de los estudios publicados han aplicado inyecciones de AH para la osteoartritis de rodilla, pocos artículos de la eficacia del PRP y menos aún, o de la mezcla de este con AH. Curiosamente, los estudios clínicos demuestran claramente el creciente interés en las inyecciones de PRP para el tratamiento del dolor de la OA, on el número de estudios clínicos publicados aumentando en los últimos años, pero hay escasas publicaciones sobre la combinación de PRP y AH en la OA de rodilla y más particularmente con el subtipo de AH, HYMOVIS®.
La administración intrarticular de AH para el tratamiento sintomático de la OA de rodilla nace con el propósito de la condropreservación, es decir, de reducir los síntomas dolorosos y proporcionar un sustituto temporal para el líquido sinovial y ha demostrado ser eficaz a nivel terapéutico para frenar el deterioro progresivo del cartílago articular (10).
Pero no todos los ácidos hialurónicos son iguales. HYMOVIS® con su estructura química particular, permanece en la articulación durante 28 días y es capaz de conservar su estructura de red tridimensional, y por ello mantener el efecto absorbente de impactos, incluso después de tensiones repetidas. La alta lubrificación también reduce la fricción entre las superficies del cartílago, promoviendo el inicio de su cicatrización por las propiedades biológicas del propio polímero, lo que conduce a una mejoría de la función articular. Estas características lo hacen especialmente adecuado para aquellos pacientes con OA. HYMOVIS® puede retrasar la progresión de la lesión del cartílago mejorando la función articular, reduciendo con ello los síntomas de dolor (12).
Contrariamente al resto de los ácidos hialurónicos, el mecanismo de acción de HYMOVIS® es doble: ejerce una actividad biológica que se expresa por su actividad antiinflamatoria y la reducción de la progresión del daño del cartílago gracias a la capacidad de la molécula para unirse a receptores específicos de sinoviocitos y condrocitos que modulan la liberación de mediadores específicos, y al mismo tiempo funciona como un fuerte lubrificante y como un amortiguador gracias a las características viscoelásticas del biopolímero, que se comporta como una almohadilla de protección tridimensional (Tecnología -MO.RE.®) (12).
Escasos trabajos (20) han descrito el uso de PRP como terapia para el dolor de la OA de rodilla, aunque algunos (20) han descrito buenos resultados en general. Debido a que el PRP autólogo se obtiene de la propia sangre del paciente, conlleva bajos riesgos de infección y reacción alérgica (13). Además, se sabe que el PRP tiene propiedades antiinflamatorias y antimicrobianas (21), lo que a su vez podría reducir el riesgo de infección postquirúrgica.
Nuestros resultados previos con la terapia de PRP epidural e intradiscal (22) demuestra mejoras notables y significativas en la intensidad del dolor media con el VAS y mejoras en la capacidad funcional medidas con el ODI. Los efectos clínicamente beneficiosos han permitido a los pacientes volver a la actividad física normal en el estudio de Raeissadat y cols. (23) y también en el nuestro. El número de inyecciones (individuales, múltiples o en múltiples niveles), el volumen de PRP inyectado (1-5 ml), el volumen sanguíneo completo inicial (9-20 ml) y los periodos de seguimiento son diferentes en los estudios contemplados, además en ninguno de ellos se aplicaba un tratamiento combinado. Los procedimientos de aislamiento de PRP utilizados en los estudios son similares al nuestro. Implicaban la centrifugación de toda la sangre de los pacientes y el uso de un kit comercial (21).
A pesar de que la aplicación clínica de la inyección de PRP para la OA de rodilla y cadera está ganando popularidad, un aspecto importante que debe considerarse es la edad de la población objetivo, nuestros pacientes con un rango de edad de 35 a 81 años demuestran que el tratamiento puede ser útil prácticamente en cualquier edad. El impacto de la edad en la eficacia de las inyecciones de factores de crecimiento se discute ampliamente en este estudio (16), un bajo número de células funcionales en los cartílagos de pacientes mayores podría obstaculizar la eficacia de las inyecciones de PRP, aunque esto no lo hemos observado nosotros, pero parece lógico que la terapia PRP será más eficiente si se aplica antes de que la degeneración articular llegue a una etapa avanzada, por lo cual nuestra práctica es aplicarla lo antes posible.
La rentabilidad de la terapia PRP + AH sigue siendo controvertida. Sabemos que es más caro que las inyecciones de esteroides cuando se utiliza a corto plazo, pero potencialmente menos costoso cuando se utiliza para el tratamiento a largo plazo (21). Por otro lado, la terapia PRP es ampliamente descrita como rentable, ya que es de naturaleza autóloga, sencilla de preparar y fácilmente disponible (23). La combinación de PRP y AH podría suponer un mayor coste inicialmente, pero quizás reduciría la necesidad de cirugía a largo tiempo y por tanto también menos coste económico.
Una de las principales controversias en este campo es el momento y la duración de la inyección y si puede tener un impacto en su eficacia y sostenibilidad. Se ha comparado (24) las inyecciones intraarticulares de Hylan G-F 20 y salina en pacientes con OA, informando que el alivio óptimo del dolor se notó en el grupo de AH tan pronto como la 3.ª semana, mientras que la mejora funcional se vio en la 8.ª semana.
En 2003 (25) se informó que 3 inyecciones de AH serían seguras y una opción esencial para que el OA de cadera de leve a moderada para producir un alivio rápido del dolor. Aparte de que la inyección intrarticular de AH fue notablemente eficaz en el alivio del dolor, también se asoció con la reducción del 48,2 % del consumo de AINE en el 3.er mes en comparación con los valores basales (26). La conclusión de los estudios indican que la inyección de AH sería considerado como la mejor línea de tratamiento conservador para la OA de rodilla con alivio sustancial del dolor y mejora de la función (17-19,27).
En líneas generales, desde el inicio hasta los 6 meses, todos los pacientes mejoran las escalas, VAS y WOMAC. Sin embargo, desde los 6 hasta los 12 meses no hay mejoría, y surge algo interesante, en los grupos AH y PRP se empeora, aunque de forma no significativa, se puede suponer que la causa sea por pérdida de eficacia. En cambio, en el grupo PRP + AH continúan mejorando a los 12 meses, aunque ya no de forma significativa, seguramente por el tamaño muestral.
En nuestro estudio, al comparar los tres grupos entre sí no se encontraron diferencias significativas en la evaluación del dolor, sin embargo, la capacidad funcional a los 6 y 12 meses en el grupo combinado de PRP + AH fue mejor, resultados similares a los referidos en metanálisis reciente (17).
Evidentemente nuestro estudio tiene la debilidad de no haber incluido un grupo placebo, lo que no hemos hecho por basarnos en un estudio con intención de tratar. En el futuro de la terapia PRP hay que incluir la realización de ensayos clínicos aleatorizados y controlados con placebo para proporcionar evidencia de mayor calidad. Se necesita más investigación para investigar los efectos a largo plazo de las inyecciones de PRP y su combinación con otros agentes, incluyendo posibles efectos adversos, durante periodos de seguimiento más largos. Una posible dirección clínica futura sería comparar regímenes de inyección únicos y múltiples dentro del mismo estudio. Otros aspectos como el método de preparación de PRP, incluyendo el inicio de volumen sanguíneo entero, concentración plaquetaria, composición PRP y cantidad de PRP inyectado deben ser investigados más a fondo. La investigación adicional sobre los aspectos anteriores será ventajosa para proporcionar una mejor orientación e indicaciones para determinar los planes de tratamiento individuales.
Conclusiones
Los resultados indican que las inyecciones intraarticulares de PRP y hexadecilamida de hialuronato sódico (Hymovis), solos o en combinación, ofrecen una mejora clínica significativa en pacientes con OA de rodilla sin efectos secundarios relevantes. El beneficio fue significativamente estable en los 3 grupos hasta 12 meses. La combinación de PRP + AH condujo a los mejores resultados en el dolor y la movilidad.
BIBLIOGRAFÍA
1. Berenbaum F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!). Osteoarthr Cartil. 2013;21(1):16-21. DOI: 10.1016/j.joca.2012.11.012.
2. Blanco FJ, Silva-Díaz M, Quevedo Vila V, Seoane-Mato D, Pérez Ruiz F, Juan-Mas A, et al; en representación del Grupo de Trabajo del Proyecto EPISER2016. Prevalence of symptomatic osteoarthritis in Spain: EPISER2016 study. Reumatol Clin (Engl Ed). 2020:S1699-258X(20)30023-1. DOI: 10.1016/j.reuma.2020.01.008. DOI: 10.1016/j.reuma.2020.01.008.
3. Moskowitz RW. The burden of osteoarthritis: clinical and quality- of-life issues. Am J Manag Care. 2009;15(8 Suppl):S223-S229.
4. Puig-Junoy J, Ruiz Zamora A. Socio-economic costs of osteo- arthritis: a systematic review of cost-of-illness studies. Semin Arthritis Rheum. 2015;44(5):531-41.
DOI: 10.1016/j.semarthrit.2014.10.012.
5. Herrero-Beaumont G, Roman-Blas JA, Bruyère O, Cooper C, Kanis J, Maggi S, et al. Clinical settings in knee osteoarthritis: pathophysiology guides treatment. Maturitas. 2017; 96:54-7. DOI: 10.1016/j.maturitas.2016.11.013.
6. Zhang W, Moskowitz RW, Nuki G, Abramson S, Altman RD, Arden N, et al. OARSI recommendations for the management of hip and knee osteoarthritis, Part II: OARSI evidence-based, expert consensus guidelines. Osteoarthritis Cartilage. 2008;16(2):137-62. DOI: 10.1016/j.joca.2007.12.013.
7. Center for Disease Control and Prevention [Internet]. Fact Sheet; 2021. Disponible en:https://www.cdc.gov/arthritis/basics/osteoarthritis.htm. Accessed 24 May 2021
8. Bowman S, Awad ME, Hamrick MW, Hunter M, Fulzele S. Recent advances in hyaluronic acid based therapy for osteoarthritis. Clin Trans Med. 2018;7(1):6. DOI: 10.1186/s40169-017-0180-3.
9. Oe M, Tashiro T, Yoshida H, Nishiyama H, Masuda Y, Maruyama K, et al. Oral hyaluronan relieves knee pain: a review. Nutr J. 2015; 15:11. DOI: 10.1186/s12937-016-0128-2.
10. Moreland LW. Intra-articular hyaluronan (hyaluronic acid) and hylans for the treatment of osteoarthritis: mechanisms of action. Arthri- tis Res Ther. 2003;5(2):54-67. DOI: 10.1186/ar623.
11. Cooper C, Rannou F, Richette P, Bruyère O, Al-Daghri N, Altman RD, et al. Use of intraarticular hyaluronic acid in the management of knee osteoarthritis in clinical practice. Arthritis Care Res (Hoboken). 2017;69(9):1287-96.
DOI: 10.1002/acr.23204.
12. Priano F. Early Efficacy of Intra-Articular HYADD® 4 (Hymovis®) Injections for Symptomatic Knee Osteoarthritis. Joints. 2017;5(2):79-84. DOI: 10.1055/s-0037-1603677.
13. Nguyen C, Rannou F. The safety of intra-articular injections for the treatment of knee osteoarthritis: a critical narrative review. Expert Opin Drug Saf. 2017;16(8):897-902.
DOI: 10.1080/14740338.2017.1344211.
14. Vad VB, Sakalkale D, Sculco TP, Wickiewicz TL. Role of hylan G-F 20 in treatment of osteoarthritis of the hip joint. Arch Phys Med Rehabil. 2003;84(2):1224-6. DOI: 10.1016/S0003-9993(03)00140-0.
15. Battaglia M, Guaraldi F, Vannini F, Rossi G, Timoncini A, Buda R, et al. Efficacy of ultrasound-guided intra-articular injections of platelet-rich plasma versus hyaluronic acid for hip osteoar- thritis. Orthopedics. 2013;36(12):e1501-e1508. DOI: 10.3928/01477447-20131120-13.
16. Dallari D, Stagni C, Rani N, Sabbioni G, Pelotti P, Torricelli P, et al. Ultrasound-guided injection of platelet-rich plasma and hyaluronic acid, separately and in combination, for hip osteoarthritis: a Randomized Controlled Study. Am J Sports Med. 2016;44(3):664-71. DOI: 10.1177/0363546515620383.
17. Han Y, Huang H, Pan J, Lin J, Zeng L, Liang G, et al. Meta-analysis. comparing platelet-rich plasma vs hyaluronic acid injection in patients with knee osteoarthritis. Pain Med. 2019;20(7):1418-29. DOI: 10.1093/pm/pnz011.
18. Di Martino A, Di Matteo B, Papio T, Tentoni F, Selleri F, Cenacchi A, et al. Platelet-rich plasma versus hyaluronic
acid injections for the treatment of knee osteoarthritis:
results at 5 years of a double-blind, randomized controlled trial. Am J Sports Med. 2019;47(2):347-54.
DOI: 10.1177/0363546518814532.
19. Zhao J, Huang H, Liang G, Zeng LF, Yang W, Liu J. Effects and safety of the combination of platelet-rich plasma (PRP) and hyaluronic acid (HA) in the treatment of knee osteoarthritis: a systematic review and meta-analysis. BMC Musculoskelet Disord. 2020;21(1):224. DOI: 10.1186/s12891-020-03262-w.
20. Bansal H, Leon J, Pont JL, Wilson DA, Bansal A, Agarwal D, et al. Platelet-rich plasma (PRP) in osteoarthritis (OA) knee: Correct dose critical for long term clinical efficacy. Sci Rep. 2021;11(1):3971. DOI: 10.1038/s41598-021-83025-2.
21. Moussa M, Lajeunesse D, Hilal G, El Atat O, Haykal G, Serhal R, et al. Platelet-rich plasma (PRP) induces chondroprotection via increasing autophagy, anti-Infammatory markers, and decreasing apoptosis in human osteoarthritic cartilage. Exp Cell Res. 2017;352(1):146-56. DOI: 10.1016/j.yexcr.2017.02.012.
22. Torres LM, García-Palacios M, Benítez D, Eizaga R, López-López J, Sánchez de las Matas R, et al. Tratamiento con la administración intradiscal de plasma rico en plaquetas para dolor crónico discogénico cervical y lumbar. MPJ. 2021;1.
DOI: 1020986/mpj20211001/2021.
23. Raeissadat SA, Rayegani SM, Babaee M, Ghorbani E. The effect of platelet-rich plasma on pain, function, and quality of life of patients with knee osteoarthritis. Pain Res Treat. 2013;2013:165967. DOI: 10.1155/2013/165967.
24. Cubukçu D, Ardiç F, Karabulut N, Topuz O. Hylan G-F 20 efficacy on articular cartilage quality in patients with knee osteoarthritis: clinical and MRI assessment. Clin Rheumatol. 2005;24(4):336-41. DOI: 10.1007/s10067-004-1043-z.
25. Vad VB, Sakalkale D, Sculco TP, Wickiewicz TL. Role of hylan G-F 20 in treatment of osteoarthritis of the hip joint. Arch Phys Med Rehabil. 2003;84(8):1224-6. DOI: 10.1016/S0003-9993(03)00140-0.
26. Piccirilli E, Oliva F, Murè MA, Mahmoud A, Foti C, Tarantino U, et al. Viscosupplementation with intra-articular hyaluronic acid for hip disorders. A systematic review and meta-analysis. Muscles Ligaments Tendons J. 2016;6(3):293-9. DOI: 10.32098/mltj.03.2016.04.
27. Chang KV, Hsiao MY, Chen WS, Wang TG, Chien KL. Effectiveness of intra-articular hyaluronic acid for ankle osteoarthritis treatment: a systematic review and meta-analysis. Arch Phys Med Rehabil. 2013;94(5):951-60. DOI: 10.1016/j.apmr.2012.10.030.