Introducción
En el año 2020, la Asociación Internacional para el Estudio del Dolor (International Association for the Study of Pain –IASP–) redefinió el dolor como “una experiencia sensorial y emocional desagradable asociada, o similar a la asociada, con daño tisular real o potencial” (1). Además, la Clasificación Internacional de Enfermedades (ICD-11) caracteriza el dolor crónico como aquel que persiste o se repite durante más de 3 meses (2). Estas definiciones destacan la complejidad y variabilidad del dolor en cuanto a presentación sintomática, no solo como una sensación física, sino como un fenómeno multidimensional que impacta profundamente la calidad de vida de los pacientes.
El dolor afecta diariamente a miles de millones de personas en todo el mundo, constituyendo no solo una experiencia universal, sino también una de las principales causas de discapacidad y mortalidad (3). Su omnipresencia y sus implicaciones en la calidad de vida y el bienestar social lo posicionan como una prioridad ineludible para la salud global. Dentro de este panorama, el dolor neuropático, un subtipo de dolor crónico, emerge como un desafío clínico particularmente complejo. Su elevada prevalencia, que afecta al 7-10 % de la población general, y su resistencia a los tratamientos convencionales con analgésicos y otros enfoques farmacológicos como fármacos antidepresivos y antiepilépticos, subrayan la necesidad de terapias más efectivas y personalizadas. Este subtipo de dolor, a menudo refractario, no solo perpetúa el sufrimiento de los pacientes, sino que también sobrecarga los sistemas de salud en todo el mundo (4).
En este contexto, la estimulación magnética transcraneal (TMS, por sus siglas en inglés, transcranial magnetic stimulation) ha emergido como una herramienta prometedora en el manejo del dolor crónico. La TMS es una técnica de neuromodulación no invasiva que utiliza pulsos electromagnéticos dirigidos a áreas específicas del cerebro para modular la actividad neuronal (5,6). Desde su introducción en neurociencias como herramienta para investigar procesos cerebrales (7), pasando por su utilización diagnóstica, TMS, particularmente en su versión repetitiva (rTMS), ha demostrado además ser eficaz en una variedad de condiciones, incluyendo trastornos depresivos (8), rehabilitación neurológica (9) y, más recientemente, en el tratamiento del dolor crónico (10).
Entre las modalidades de neuromodulación no invasiva disponibles, la TMS se distingue por su capacidad para intervenir de manera focal y controlada en regiones cerebrales específicas, con un perfil de seguridad favorable y sin los riesgos asociados a intervenciones más invasivas y con mayor riesgo potencial de desarrollar convulsiones (6). Esta técnica se suma a un creciente arsenal terapéutico que incluye otras modalidades como la estimulación por corriente directa y la estimulación eléctrica (no invasiva o percutánea) del nervio vago, cada una con sus propias aplicaciones y limitaciones. Sin embargo, la TMS destaca particularmente en el ámbito del dolor crónico por su capacidad de personalización y su impacto directo en circuitos neuronales de la “neuromatrix del dolor” (11).
El presente artículo tiene como objetivo explorar el estado del arte en el uso de TMS para el manejo del dolor crónico, enfocándose en sus fundamentos, eficacia y algoritmos terapéuticos. A través de una revisión exhaustiva de la literatura y la experiencia de pioneros como el Dr. Jean-Pascal Lefaucheur, buscamos delinear un marco comprensivo que permita optimizar las indicaciones y resultados de esta herramienta en la práctica clínica y proponer un algoritmo para su utilización práctica y lógica en el área de dolor crónico.
Neuromodulación no invasiva en dolor
El dolor crónico, particularmente el neuropático, representa un desafío significativo en la práctica clínica. Las técnicas de neuromodulación no invasiva han surgido como alternativas prometedoras al ofrecer opciones terapéuticas efectivas sin los riesgos asociados a procedimientos invasivos. Entre estas, la estimulación transcraneal por corriente directa ha mostrado utilidad en ciertos tipos de dolor, aunque sus efectos suelen ser de corta duración y altamente variables entre pacientes (12). Por otro lado, la estimulación eléctrica transcutánea del nervio vago ofrece un enfoque innovador, aunque su aplicación clínica en dolor todavía se encuentra en una etapa incipiente (13).
Dentro de este panorama, TMS ha ganado un lugar destacado por su capacidad de intervenir de manera precisa en regiones cerebrales implicadas en la percepción del dolor. Su perfil de seguridad, respaldado por una creciente evidencia científica, y la posibilidad de personalizar los parámetros de tratamiento, han consolidado a la TMS como una herramienta clave en el manejo de diversas variantes del dolor crónico (14). En los últimos años, su uso ha crecido de manera sostenida, posicionándose como una opción terapéutica de gran relevancia para pacientes con respuestas insuficientes a los tratamientos tradicionales (Figura 1, A y B).
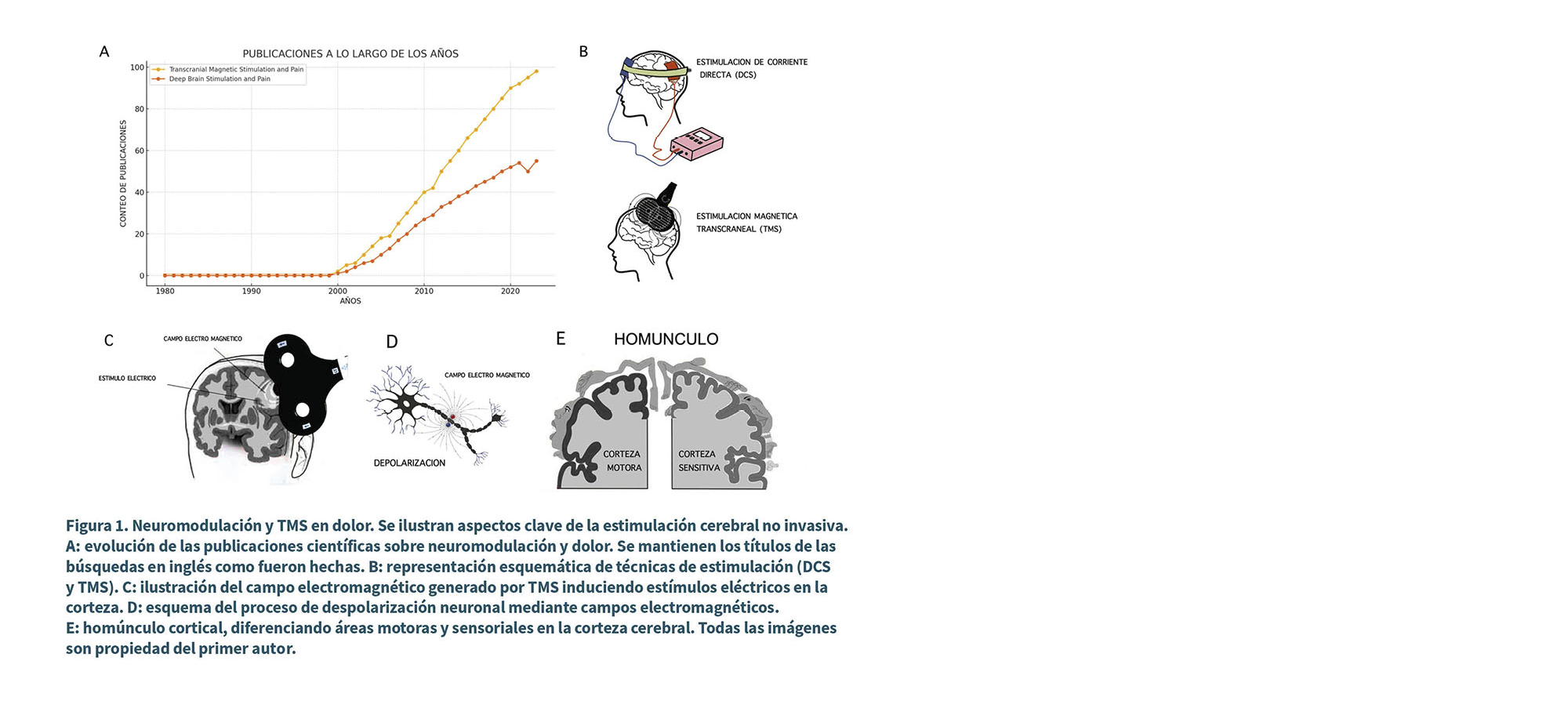
TMS y dolor
El mecanismo electromagnético y neurofisiológico de la estimulación magnética transcraneal radica en la generación de pulsos electromagnéticos mediante un dispositivo externo colocado sobre el cuero cabelludo. Estos inducen corrientes eléctricas en la corteza cerebral subyacente, modulando la actividad neuronal de manera no invasiva (15). Dependiendo de la frecuencia y la intensidad empleadas, la estimulación puede causar la despolarización de membrana y aumentar o disminuir la excitabilidad neuronal cortical, facilitando cambios en distintos circuitos (16) (Figura 1C y D).
En síntesis, el efecto terapéutico se sustenta en múltiples mecanismos sinérgicos de modulación cortical y reorganización sináptica. Específicamente, la estimulación de alta frecuencia sobre la corteza motora primaria (M1) induce una potenciación a largo plazo, definida como un fortalecimiento duradero de las conexiones interneuronales entre vías cortico-corticales inhibitorias (17). A su vez, este proceso inhibe las vías nociceptivas ascendentes mediante proyecciones cortico-talámicas (18) y está descrito que promueve la liberación de opioides endógenos (19). Asimismo, hay evidencia que señala una reducción de la neuroinflamación (marcada por menor gliosis y citoquinas proinflamatorias (TNF-α, IL-1β) frente al aumento de factores antinflamatorios [IL-10] [20]) y una mejora en la conectividad funcional cortico-tálamo-hipotalámica, que involucra al eje hipotálamo-hipófiso-adrenal, el cual podría contribuir un entorno neurofisiológico menos sensible al dolor (21).
Probablemente, el efecto analgésico observado no se deba a un único mecanismo aislado, sino a la convergencia de varios de estos procesos actuando en paralelo, que en conjunto configuran un entorno cerebral más resistente a la percepción del dolor en sus diversas características.
Estimulación de corteza motora primaria para dolor crónico: fundamentos
En este contexto, TMS ha sido objeto de numerosos estudios que investigan su eficacia en el tratamiento del dolor crónico, enfocándose particularmente en la estimulación de la M1 tanto en la región cortical correspondiente al área dolorosa, como a la corteza correspondiente al miembro superior, por su más amplia extensión en el homúnculo motor (Figura 1E).
Diversas investigaciones han explorado los mecanismos por los cuales la estimulación de M1 puede influir en la percepción del dolor. Entre ellas, un estudio clave realizado por Peyron y cols. en el año 2007 investigó los mecanismos cerebrales subyacentes a los efectos analgésicos de la estimulación por implante de electrodos en M1, mediante tomografía por emisión de positrones (17). Los resultados evidencian cambios significativos en el flujo sanguíneo cerebral en 2 tiempos, a saber, intraestimulación y postestimulación. Las regiones corticales y subcorticales asociadas con el control del dolor que mostraron cambios en el flujo sanguíneo cerebral fueron la corteza cingulada anterior pregenual, el tálamo y el mesencéfalo, incluyendo la sustancia gris periacueductal.
Con relación a los tiempos en los que se midió, durante la estimulación, se observó una activación en la corteza cingulada media, mientras que en el periodo postestimulación se activaron redes más amplias que incluían áreas prefrontales, orbitofrontales y estructuras subcorticales. Este patrón sugiere que la TMS aplicada sobre M1 podría actuar mediante complejos mecanismos descendentes, los cuales modulan la transmisión nociceptiva a través de conexiones entre corteza, núcleos de la base y otras regiones del tronco encefálico en distintos tiempos que exceden el momento mismo de la estimulación.
Estos hallazgos resaltan el papel central de la M1 como objetivo terapéutico en el manejo del dolor crónico.
Indicaciones clínicas y consensos en la utilización de TMS para el tratamiento del dolor
En 2004, Jean-Pascal Lefaucheur y sus colaboradores reportaron el caso pionero de una mujer con dolor neuropático periférico resistente a terapia farmacológica que pudo obtener control de su dolor durante más de un año mediante la realización de una sesión mensual de TMS, hasta la colocación de un neuroestimulador cortical. Los valores iniciales promedio de la escala visual numérica eran mayores a 7/10. Después de cada sesión, el promedio de escala visual numérica fue siempre inferior a 5,5/10 (22).
En el año 2025, ya contamos con guías clínicas internacionales de consenso en la utilización de rTMS para múltiples patologías (1,23), existe nivel de evidencia “A” para el uso de rTMS de alta frecuencia sobre la M1 en el tratamiento del dolor neuropático central postictus, la neuralgia del trigémino y el dolor asociado a lesión medular. Estudios clínicos controlados han mostrado reducciones significativas en la intensidad del dolor; por ejemplo, en pacientes con neuralgia postherpética, el alivio alcanzó entre el 45–50 %, con efectos sostenidos hasta 3 meses tras el tratamiento (24). En casos de dolor relacionado con cáncer, se observaron reducciones del 35-40 %, aunque con efecto más transitorio (25).
Además, investigaciones recientes destacan que el uso de rTMS guiado por neuronavegación puede optimizar el efecto analgésico, y que incluso al utilizar un objetivo universal como el área motora de la mano se logran respuestas favorables en múltiples tipos de dolor, independientemente de su localización. También se ha reportado un efecto acumulativo positivo con la repetición sostenida de sesiones a lo largo del tiempo, especialmente en dolor central postictus y facial (26,27).
Se ha observado eficacia adicional en condiciones como la fibromialgia, donde la rTMS ha mostrado beneficios tanto analgésicos como funcionales en diversos ensayos clínicos (28).
Adicionalmente, en el último consenso latinoamericano y caribeño sobre neuromodulación no invasiva del sistema nervioso central para el manejo del dolor crónico publicado en Pain Reports, que proporciona recomendaciones basadas en evidencia, destaca que la estimulación de M1 mediante TMS de alta frecuencia tiene un nivel de recomendación A para fibromialgia y dolor neuropático, y un nivel B para dolor miofascial o musculoesquelético, síndrome de dolor regional complejo y migraña. Estas recomendaciones se basan en una revisión sistemática de estudios clínicos que demuestran la eficacia de TMS y otras diversas estrategias terapéuticas en el tratamiento del dolor (29).
Protocolización de TMS en dolor neuropático y crónico
Estimulación cortical crónica y TMS
Tal como se mencionó anteriormente, el tratamiento de TMS sobre la M1 presenta una estrecha relación con el tratamiento de estimulación cortical crónica de M1 (MCS) propuesta inicialmente por Tsubokawa y por Meyerson (30,31). Una técnica que contempla el implante epidural en el área correspondiente a la circunvolución precentral, identificada en forma intraoperatoria. Este electrodo es conectado mediante extensiones a un generador de impulsos, que se implanta en un bolsillo subcutáneo por debajo de la clavícula, es responsable de la administración de estímulos eléctricos cuyos parámetros pueden modificarse externamente por telemetría obteniendo la mejor programación “a medida” en cada paciente en particular.
Este abordaje terapéutico ha mostrado eficacia en el alivio de dolores neuropáticos refractarios y en funciones motoras en ciertos trastornos del movimiento. En 2019, Henssen y cols. publicaron un artículo que ofrece un análisis sistemático y un modelo predictivo a través de redes neuronales que identifica variables puntuales asociadas con una mejor respuesta al implante de MCS de M1 en pacientes con dolor crónico (32).
El modelo utilizado fue una red neuronal artificial (ANN) de tipo multicapa, que permite identificar correlaciones complejas entre múltiples variables clínicas y demográficas. Henssen y cols. evaluaron a más de 358 pacientes y encontraron 6 variables con significativo valor predictivo:
1. Sexo del paciente. Las mujeres respondieron mejor al tratamiento.
2. Origen de la lesión. Las lesiones centrales mostraron mayor tasa de respuesta que las periféricas.
3. Escala de dolor preoperatoria NRS. Un menor puntaje preoperatorio se asoció con mejores resultados.
4. Uso preoperatorio de rTMS. Los pacientes que respondieron positivamente a la TMS previo presentaron mayor probabilidad de éxito con MCS.
5. Consumo preoperatorio de opioides. Se asoció con peores resultados.
6. Periodo de seguimiento. Un seguimiento prolongado mostró mejores tasas de respuesta clínica.
El uso de TMS repetitivo como herramienta predictiva previa al implante de MCS es uno de los hallazgos clave del artículo, destacando su relevancia no solo como tratamiento, sino como un ensayo pronóstico. Esta práctica permite evaluar la posible respuesta del paciente antes de un procedimiento invasivo, optimizando la selección de candidatos para la terapia con MCS, optimizando las tasas de éxito de la terapia.
Predictores y algoritmos utilizados en el tratamiento del dolor con TMS
Más recientemente fueron publicados trabajos similares al de Henssen y cols. buscando predictores de respuesta a la estimulación de alta frecuencia por TMS sobre M1. En un estudio publicado este mismo año (33), los investigadores emplearon un diseño experimental que involucró la aplicación rTMS de alta frecuencia sobre M1 en pacientes con dolor neuropático. Se evaluaron diversas variables clínicas y demográficas de los participantes antes del tratamiento. Posteriormente, se analizaron las respuestas al tratamiento para identificar patrones y correlaciones entre las características basales de los pacientes y la eficacia de la rTMS.
A partir de esta metodología llegaron a un algoritmo predictivo que incluyó 3 variables principales: 2 psicológicas (síntomas depresivos y la dimensión de magnificación de la Pain Catastrophizing Scale) y una relacionada con la distribución del dolor (dolor en extremidades inferiores distales). Este modelo demostró una sensibilidad del 85 % (p = 0,005) y una especificidad del 84 % (p < 0,0001) para predecir una buena respuesta al tratamiento con rTMS en M1 a las 25 semanas.
En este contexto, la labor del previamente mencionado médico e investigador, Jean-Pascal Lefaucheur, vuelve a resultar fundamental como referente clave en la protocolización y estandarización de la técnica.
A la hora de revisar su extensa bibliografía sobre la temática, se encuentra particularmente llamativo un artículo titulado “A practical algorithm for using rTMS to treat patients with chronic pain” (Un algoritmo práctico para el uso de rTMS en el tratamiento de pacientes con dolor crónico) (34), donde Lefaucheur y Nguyen presentan un marco estructurado para la implementación de rTMS en pacientes con dolor crónico. En este artículo se destaca la importancia de parámetros como la frecuencia de estimulación, la intensidad y la precisión anatómica. Un aspecto central de dicha publicación es lograr resumir visualmente en un algoritmo terapéutico el manejo del paciente.
Mapa de ruta para la utilización de TMS en dolor o “TMS pain-roadmap”
A partir de los avances descritos en el apartado anterior, y considerando los hallazgos más recientes sobre la predicción de respuesta al tratamiento con rTMS en M1, hemos desarrollado un algoritmo clínico, utilizando los predictores clínicos y el algoritmo terapéutico nombrados en el apartado anterior (33,34). Al combinar estas aproximaciones se forma un marco práctico y en español para abordar la terapéutica de TMS en un paciente con dolor crónico. Este algoritmo, representado en la Figura 2, integra variables clave como la magnificación del dolor (PCS), los síntomas depresivos (HADS) y la localización del dolor en extremidades inferiores, que han demostrado ser predictores consistentes para optimizar la selección de pacientes (33).
El flujo comienza con la evaluación de estas variables predictivas iniciales, seguida de una selección cuidadosa de candidatos ideales para el tratamiento. Posteriormente, se implementa una fase de inducción con un protocolo estándar de rTMS de 5 sesiones, cuya respuesta es evaluada según la reducción del dolor en la escala VAS (> 50 % para buena respuesta, > 30 % para respuesta moderada). En casos de respuesta insuficiente, el algoritmo contempla ajustes en los parámetros o cambios en el objetivo de estimulación, optimizando las intervenciones antes de considerar el tratamiento como ineficaz. Para quienes alcanzan una buena respuesta, se establece una fase de mantenimiento con monitoreo continuo (ver Figura 2).
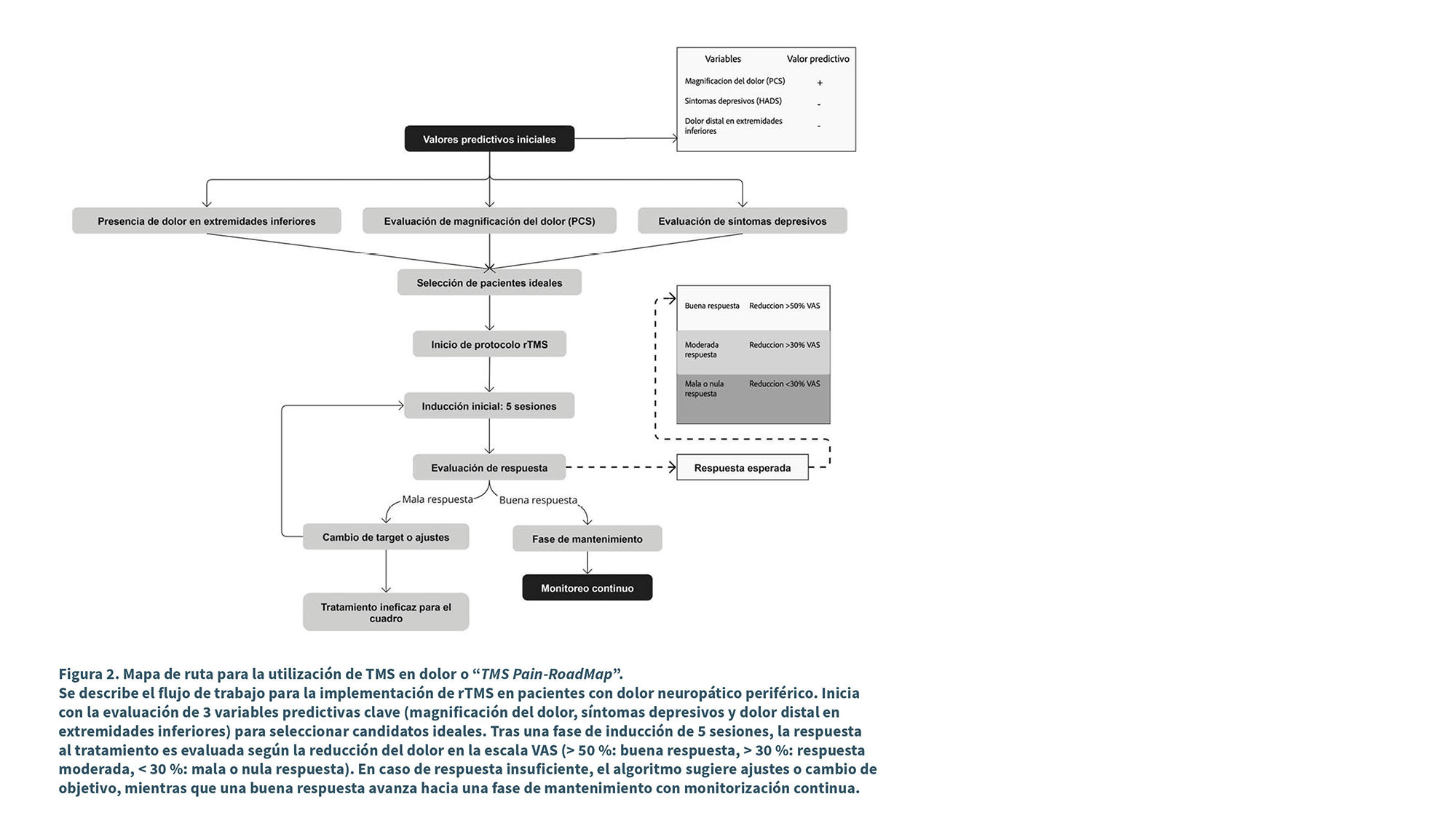
Este modelo no solo integra las evidencias más relevantes, sino que también propone una herramienta práctica para guiar la toma de decisiones clínicas en el tratamiento del dolor neuropático con rTMS.
Conclusión
Que la estimulación magnética transcraneal ha emergido como una herramienta transformadora en el manejo de varias patologías, incluyendo el dolor crónico, brindando una alternativa viable y no invasiva a terapias tradicionales es un hecho. A través de su capacidad para modular de manera focal la actividad neuronal, esta técnica inaugura un nuevo camino hacia la personalización terapéutica.
Con el liderazgo de pioneros como el Dr. Jean-Pascal Lefaucheur y el desarrollo de algoritmos clínicos prácticos, se ha avanzado significativamente en la protocolización de esta terapéutica, optimizando tanto la selección de pacientes como los parámetros de tratamiento. Este progreso, respaldado por evidencia cada vez más consistente y nuevas metodologías predictivas, permite no solo mejorar los resultados clínicos, sino también evitar tratamientos costosos e ineficaces para pacientes menos propensos a responder.
Queda el reto, ahora, de integrar estas herramientas en la práctica clínica diaria de manera accesible, eficiente y universal.
En palabras del gran médico humanista Edward Trudeau, “Cura a veces, alivia a menudo, consuela siempre”. La práctica de buscar incansablemente nuevas herramientas para el tratamiento del dolor encarna esta filosofía.
Agradecimientos
Agradecemos especialmente al Dr. Eduardo Marchevsky, experto en medicina del dolor, sus valiosos aportes de edición y supervisión del presente trabajo.
Conflicto de intereses
Ninguno.
Financiación
Ninguna.
Bibliografía
1. Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain: Concepts, challenges, and compromises. Pain. 2020;161(9):1976-82. DOI: 10.1097/j.pain.0000000000001939.
2. World Health Organization. ICD-11 for Mortality and Morbidity Statistics (ICD-11 MMS). Disponible en: https://icd.who.int.
3. Zajacova A, Grol-Prokopczyk H, Zimmer Z. Pain prevalence across 52 countries: new empirical evidence and trends from 1991 to 2015. J Pain. 2022;23(3):446-56.
4. Treede RD, Jensen TS, Campbell JN, Cruccu G, Dostrovsky JO, Griffin JW, et al. Neuropathic pain: Redefinition and a grading system for clinical and research purposes. Neurology. 2008;70(18):1630-5. DOI: 10.1212/01.wnl.0000282763.29778.59.
5. Malavera MA, Fregni F, Carrillo-Ruiz JD, Sánchez-Loyo LM, Alonso-Vanegas MA, Alonzo J, et al. Fundamentos y aplicaciones clínicas de la estimulación magnética transcraneal en neuropsiquiatría. Rev Colomb Psiquiatr. 2014;43(3):146-57. DOI: 10.1016/S0034-7450(14)70040-X.
6. Edwards MJ, Talelli P, Rothwell JC. Transcranial magnetic stimulation for the neurological patient: Scientific principles and applications. Pract Neurol. 2008;8(6):343-9.
7. Kobayashi M, Pascual-Leone A. Transcranial magnetic stimulation in neurology. Lancet Neurol. 2003;2(3):145-56. DOI: 10.1016/S1474-4422(03)00321-1.
8. Rizvi SJ, Khan A. Use of transcranial magnetic stimulation for depression. Cureus. 2019;11(5):e4736. DOI: 10.7759/cureus.4736.
9. Lefaucheur JP, Drouot X, von Raison F, Ménard-Lefaucheur I, Cesaro P, Nguyen JP. Usefulness of repetitive transcranial magnetic stimulation in the treatment of motor symptoms of stroke. Neurophysiol Clin. 2012;42(5-6):281-8.
10. Fitzgibbon BM, Pellizzer G, Sforza A, Fogassi L, Cossu G. New updates on transcranial magnetic stimulation in chronic pain. Curr Pain Headache Rep. 2022;26(5):355-66.
11. Xiong HY, Yang Y, Zhang Q, Li Y, Fan J. Non-invasive brain stimulation for chronic pain: State of the art and future directions. Front Mol Neurosci. 2022;15:888716. DOI: 10.3389/fnmol.2022.888716.
12. Vergallito A, Feroldi S, Pisoni A, Romero Lauro LJ. Inter-individual variability in tDCS effects: A narrative review on the contribution of stable, variable, and contextual factors. Brain Sci. 2022;12(5):522. DOI: 10.3390/brainsci12050522.
13. Costa V, Gianlorenço A, Andrade MF, Camargo L, Menacho M, Arias Avila M, et al. Transcutaneous vagus nerve stimulation effects on chronic pain: Systematic review and meta-analysis. Pain Rep. 2024;9(5):e1171. DOI: 10.1097/PR9.0000000000001171.
14. Lefaucheur JP, Aleman A, Baeken C, Benninger DH, Brunelin J, di Lazzaro V, et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): An update (2014-2018). Clin Neurophysiol. 2020;131(2):474-528. DOI: 10.1016/j.clinph.2019.11.002.
15. Chervyakov AV, Chernyavsky AY, Sinitsyn DO, Piradov MA. Possible mechanisms underlying the therapeutic effects of transcranial magnetic stimulation. Front Hum Neurosci. 2015;9:303. DOI: 10.3389/fnhum.2015.00303.
16. Yang S, Chang MC. Effect of repetitive transcranial magnetic stimulation on pain management: a systematic narrative review. Front Neurol. 2020;11:114. DOI: 10.3389/fneur.2020.00114.
17. Peyron R, Faillenot I, Mertens P, Laurent B, Garcia-Larrea L. Motor cortex stimulation in neuropathic pain: Correlations between analgesic effect and hemodynamic changes in the brain. A PET study. Neuroimage. 2007;34(1):310-21. DOI: 10.1016/j.neuroimage.2006.08.037.
18. Garcia-Larrea L, Peyron R, Mertens P, Grégoire MC, Lavenne F, le Bars D, et al. Electrical stimulation of motor cortex for pain control: A combined PET-scan and electrophysiological study. Pain. 1999;83(2):259-73. DOI: 10.1016/S0304-3959(99)00114-1.
19. Taylor JJ, Borckardt JJ, George MS. Endogenous opioids mediate left dorsolateral prefrontal cortex rTMS-induced analgesia. Pain. 2013;154(11):2133-41.
20. Liu J, Wang Y, Lin Y, Zhang J, Cao X, Wang J, et al. Repetitive transcranial magnetic stimulation inhibits microglial activation and alleviates chronic neuropathic pain in rats. J Pain Res. 2018;11:2941-52.
21. Sun Y, Li N, Liu X, Chen Y, Yuan X, Li F, et al. rTMS improves functional connectivity and reduces neuroinflammation in spinal cord injury-induced neuropathic pain. Neurobiol Dis. 2023;181:105918.
22. Lefaucheur JP, Drouot X, Nguyen JP. Neurogenic pain relief by repetitive transcranial magnetic cortical stimulation depends on the origin and the site of pain. J Neurol Neurosurg Psychiatry. 2004;75(4):612-6. DOI: 10.1136/jnnp.2003.022236.
23. Lefaucheur JP, Drouot X, Ménard-Lefaucheur I, Keravel Y, Nguyen JP. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation: 2014 update. Clin Neurophysiol. 2014;125(11):2150-206. DOI: 10.1016/j.clinph.2014.05.021.
24. Ma SM, Ni JX, Li XY, Wang TJ, Guo Y, Chen HS, et al. High-frequency repetitive transcranial magnetic stimulation reduces pain in postherpetic neuralgia. Pain Med. 2015;16(11):2162-70. DOI: 10.1111/pme.12832.
25. Khedr EM, Kotb HI, Mostafa MG, Ahmed MA, Sadek R, Rothwell JC. Repetitive transcranial magnetic stimulation in neuropathic pain secondary to malignancy: A randomized clinical trial. Eur J Pain. 2015;19(4):519-27. DOI: 10.1002/ejp.576.
26. Pommier B, Créach C, Beauvieux V, Nuti C, Vassal F, Peyron R. Robot-guided neuronavigated rTMS as an alternative therapy for central (neuropathic) pain: Clinical experience and long-term follow-up. Eur J Pain. 2016;20(6):907-16. DOI: 10.1002/ejp.815.
27. Quesada C, Attal N, Gautron M, Brasseur L, Baudic S, et al. Robot-guided neuronavigated repetitive transcranial magnetic stimulation (rTMS) in central neuropathic pain. Arch Phys Med Rehabil. 2018;99(11):2203-15.e1. DOI: 10.1016/j.apmr.2018.04.013.
28. Boyer L, Pinsard B, Chupin M, Dousset A, et al. Effects of unilateral repetitive transcranial magnetic stimulation of the motor cortex on chronic widespread pain in fibromyalgia. Neurophysiol Clin. 2014;44(3):261-7.
29. Baptista AF, Fernandes AMBL, Nunes Sa K, Hideki Okano A, Russowsky Brunoni A, Lara-Solares A, et al. Latin American and Caribbean consensus on noninvasive central nervous system neuromodulation for chronic pain management (LAC2-NIN-CP). Pain Rep. 2019;4(1):e692. DOI: 10.1097/PR9.0000000000000692.
30. Hsieh JC, Meyerson BA, Ingvar M. Electric precentral gyrus stimulation alleviates the pain of trigeminal neuropathy: A PET study of central processing of chronic pain. Neuroimage. 1996;3(3, Suppl):S489.
31. Tsubokawa T, Katayama Y, Yamamoto T, Hirayama T, Koyama S. Chronic motor cortex stimulation in patients with thalamic pain. J Neurosurg. 1993;78(3):393-401. DOI: 10.3171/jns.1993.78.3.0393.
32. Henssen DJ, Witkam RL, Dao J, Comes DJ, van Cappellen van Walsum AM, Kozicz T, et al. Systematic review and neural network analysis to define predictive variables in implantable motor cortex stimulation to treat chronic intractable pain. J Pain. 2019;20(9):1015-26. d DOI: 10.1016/j.jpain.2019.02.004.
33. Attal N, Quesada C, Gautron M, Brasseur L, Baudic S, et al. Prediction of the response to repetitive transcranial magnetic stimulation of the motor cortex in peripheral neuropathic pain and validation of a new algorithm. Pain. 2025;166(1):34-41. DOI: 10.1097/j.pain.0000000000003297.
34. Lefaucheur JP, Nguyen JP. A practical algorithm for using rTMS to treat patients with chronic pain. Neurophysiol Clin. 2019;49(4):301-7. DOI: 10.1016/j.neucli.2019.07.014.