Introducción
La artrosis u osteoartritis (OA) afecta aproximadamente al 10 % de la población en España, especialmente a personas mayores de 50 años (1). La articulación más afectada es la rodilla, seguida de la mano, cadera, hombro y tobillo, siendo la OA de cadera y rodilla la 11.º causa que más contribuye a la discapacidad global (2). Un estudio de la Sociedad Española de Reumatología, EPISER2016 (3,4), describe una prevalencia especialmente alta de artrosis de rodilla en España, además de un aumento relacionado con la edad, muy significativo especialmente en mujeres. Si analizamos la carga económica de la OA para el Sistema Nacional de Salud, se ha visto que representa alrededor de un 25 % de pacientes atendidos en las consultas de Reumatología y un 5-7 % de las consultas de Atención Primaria (5). Esto conlleva un altísimo impacto económico para el Sistema Nacional de Salud (SNS), además de los costes indirectos derivados de la pérdida de productividad, incluyendo la incapacidad temporal o permanente (5,6). La cirugía es el tratamiento más costoso (5-7), ocupando la implantación y sustitución de prótesis el segundo lugar en los costes de los procesos quirúrgicos (5). En el caso de la OA de rodilla, los costes medios unitarios por artroplastia se estimaron en el 2019 en 7.862,7 € para rodilla y en 8.426,4 € para cadera (5).
El tratamiento de la OA persigue, a corto plazo, mejorar el dolor y la movilidad, a corto-medio plazo reducir la incapacidad funcional y a largo plazo retrasar la progresión de la enfermedad (1). Históricamente, el AH se ha utilizado preferentemente en estadios leve y moderado de la OA, pero actualmente existen trabajos que avalan el uso del AH para controlar el dolor también en estadios avanzados, mientras el paciente está en lista de espera quirúrgica y como tratamiento coadyuvante tras cirugías artroscópicas de rodilla (1,2,8,9), y así lo recogen las últimas guías. Se han realizado estudios que muestran que el AH reduce la carga económica en el SNS como consecuencia del retraso de implantación de prótesis de hasta 2,6 años (2,10). Múltiples estudios han demostrado que el AH es un tratamiento seguro (1,2,10-13). Además de estos datos clínicos, el AH tiene estudios in vitro que reflejan importantes efectos biológicos antinflamatorios, anticatabólicos y anabólicos que soportan su aplicación en la práctica clínica. A pesar de que se han realizado muchos estudios para demostrar el efecto del AH sobre la progresión estructural de la artrosis, ninguno de ellos ha sido concluyente y el AH no se considera un fármaco modificador de estructura.
En base a estos datos analizados, utilizando metodología de medicina basada en la evidencia (principalmente metanálisis y revisiones sistemáticas), el AH se incluye en varias guías de tratamiento sintomático de la OA como una opción terapéutica (2,14-16). Un ejemplo es la guía del OARSI y la del ESCEO; en la primera, con un grado de recomendación nivel 1B (≥ 75 % a favor y > 50 % condicional) y nivel 2 (60-74 % a favor) el uso de ácido hialurónico IA se recomienda condicionalmente en personas con OA de rodilla en todos los grupos.
Las guías y recomendaciones de las sociedades científicas consideran el AH como un único producto y ninguna de ellas tiene en cuenta algunas características del AH como son su origen, el método de obtención, su estructura, su peso molecular o la cantidad de AH por infiltración que pueden ser determinantes a la hora de seleccionar uno de ellos.
La duración del efecto a largo plazo del tratamiento con AH tiene un importante impacto en el ahorro económico y clínico, por lo que se trata de un aspecto fundamental a valorar. La duración del efecto de cada infiltración dependerá de varios factores: la situación basal del paciente, el grado de evolución de la OA y la técnica de infiltración, entre otros, pero uno de los factores más importantes es el AH seleccionado. Los AH que requieran un menor número de infiltraciones al año consiguen reducir el número de visitas que precisan los pacientes y contribuir así a la descarga asistencial, comportando un menor tiempo total de atención al paciente y un menor consumo de recursos sanitarios. A la vez, se disminuye el riesgo de complicaciones derivadas del propio proceso de infiltración debido al menor número de infiltraciones necesarias.
La autoridad competente en España en la regulación de productos sanitarios es la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), responsable de la vigilancia y control de los productos sanitarios en el mercado. Mediante el Organismo Notificado (CE0318), la AEMPS evalúa la conformidad de los productos sanitarios. Tras estudiar el dossier técnico, que incluye su desarrollo clínico y realizar las correspondientes auditorías, emite los certificados CE y la información del producto e instrucciones de uso (IFU). IFU es el término equivalente a la ficha técnica de medicamentos. Hablaremos, pues, de fichas técnicas por ser un término más conocido.
Material y métodos
La revisión realizada se dividió en dos fases. En una primera se analizaron las fichas técnicas de los diferentes AH y en la segunda se profundizó en la duración de acción de los AH one shot, analizando, además de su ficha técnica, las publicaciones con seguimiento superior a 6 meses.
Primera fase: revisión de las fichas técnicas de los AH comercializados en España
Se realizó una búsqueda de los productos sanitarios y medicamentos de AH comercializados en España. La base de datos utilizada fue el Botplus® del Consejo General de Farmacéuticos, (https://botplusweb.portalfarma.com), consultada en marzo de 2022. Las fichas técnicas de estos productos se obtuvieron de esta fuente o de las páginas webs de los diferentes productos, en la misma fecha.
Actualmente se comercializan 48 AH intrarticulares, de los cuales se han localizado y analizado 42 fichas técnicas: 24 de AH secuenciales y 18 de AH monodosis o one shot.
Segunda fase: revisión de AH one shot con ensayos clínicos con seguimiento superior a 6 meses
Asimismo, se realizó una búsqueda bibliográfica en PubMed con el objetivo de identificar y analizar los estudios publicados de los AH monodosis con seguimiento superior a 6 meses y contrastar sus resultados con la duración que aparece reflejada en su ficha técnica.
Se detectaron 9 estudios de duración superior a 6 meses de 6 diferentes AH (17-25). Un resumen esquemático de las publicaciones analizadas puede verse en la Tabla I del documento.
Resultados
La Tabla I recoge la clasificación de los diferentes AH según su forma de administración (secuencial o monodosis) y, dentro de esta última, aquellos de larga duración (1 año).
Entre la información que se recoge en las fichas técnicas de los AH es de destacar la siguiente:
1. La duración del efecto, una mayor duración contribuye a reducir el número de visitas médicas, el número de infiltraciones y así genera una mayor eficiencia en la gestión de los recursos sanitarios (17,18,26-29).
2. La concentración de AH determina su efecto clínico (17).
3. El volumen en el que va disuelto el AH condiciona el tamaño de la articulación a tratar; articulaciones como la cadera y la rodilla requieren volúmenes altos (29).
4. El origen del AH es un factor que contribuye a la seguridad del producto. Los AH de origen animal presentan con mayor frecuencia reacciones alérgicas y efectos adversos, mientras que los AH de origen biotecnológico reducen la posibilidad de contaminación viral y son más biocompatibles que los productos de origen animal, ya que evitan la posibilidad de transmisión de infecciones y otros efectos adversos asociados a los AH de origen aviar (29).
5. La estructura: los AH con estructura reticulada podrían mostrar una mayor incidencia de dolor e hinchazón en la zona de infiltración en los días posteriores a la infiltración (30).
6. El número de infiltraciones por ciclo impacta en el número de visitas que realiza el paciente al especialista.
7. Peso molecular: no está demostrado científicamente que sea una característica diferenciadora de mayor o menor eficacia (31,32), sino que afecta a la viscosidad, penetración en la matriz extracelular y a la lubrificación del AH. Existen estudios a favor tanto de altos como de medios pesos moleculares (33-36). Teniendo en cuenta estos resultados, el grupo de trabajo de la ESCEO considera que actualmente no hay evidencia clínica que respalde una ventaja en la eficacia de AH de alto PM sobre los de medio PM (2).
8. Composición: algunos AH añaden a su composición de base (típicamente hialuronato sódico o hilano) otros componentes como sorbitol, pero esto no ha supuesto una diferencia en términos de eficacia (37,38).
9. Clasificación del AH como medicamento o producto sanitario. La diferencia radica en el hecho de que los primeros actuarían a nivel farmacológico, mientras que los segundos ejercerían una acción física, pero esto tampoco ha supuesto una diferencia en términos de eficacia. Algunos AH clasificados como producto sanitario han demostrado (en estudios in vivo con animales o incluso en humanos) efectos sobre el proceso inflamatorio y propiedades protectoras del cartílago a través de una acción directa sobre receptores celulares (32,37).
10. Indicaciones: no todos los AH tienen aprobada su indicación en todas las articulaciones o en situaciones específicas como las postartroscopias.
AH secuenciales
En este grupo se incluyen 24 AH que se administran de forma semanal, de 3 a 5 inyecciones (Tabla II).
Duración del efecto: aproximadamente el 40 % de AH secuenciales no tienen disponible en su IFU datos de eficacia. Dos AH (Adant® 2,5 y Renehavis™) indican en su IFU que su efecto dura 12 meses. Otros dos AH (Synvisc® e Hyalgan®) indican en su IFU un efecto de 6-12 meses; y el resto de AH secuenciales que reportan datos de eficacia en IFU, señalan tener 6 meses de eficacia.
AH one shot
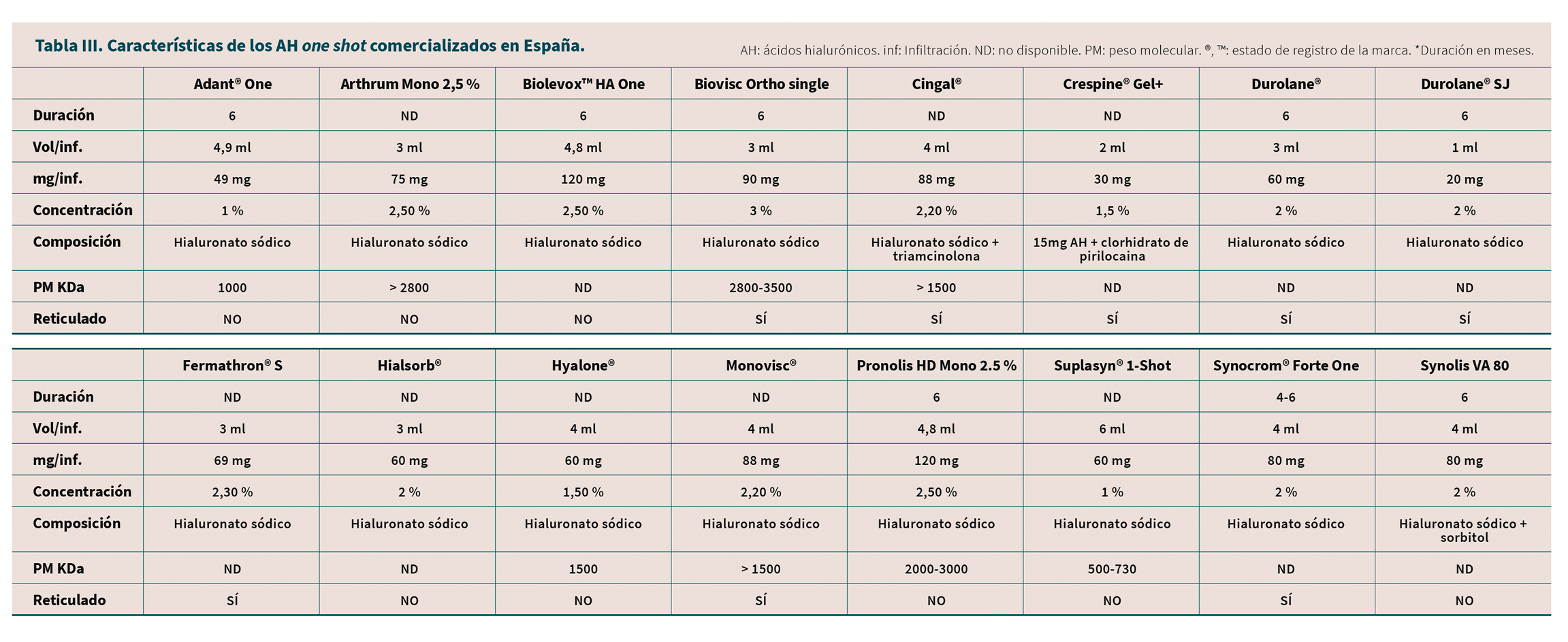
En este grupo se incluyen 18 AH que se administran una sola vez por ciclo (Tabla III). La tabla recoge las diferentes características de estos productos respecto a su volumen, concentración, PM, estructura y composición.
Todos ellos son de origen biotecnológico y están registrados en España como productos sanitarios (implante clínico, clase III).
Duración del efecto: aproximadamente el 43 % de los AH one shot no tienen disponible en su IFU datos de duración del efecto. Los AH one shot que reportan datos de eficacia en IFU señalan tener 6 meses de eficacia, excepto Synocrom® Forte One, que es de 4-6 meses.
Indicaciones: solo 2 AH one shot, con indicación en el tratamiento de la OA, disponen además de indicación en postartroscopias: Adant® One y Durolane®.
AH one shot de 1 año de duración
Los únicos AH one shot de larga duración, según se recoge en su IFU, son Adant® Plus y Synvisc One®. Revisamos sus características técnicas en la Tabla IV.
Volumen y concentración por infiltración: Adant® Plus cuenta con un volumen de 4,9 ml, 98 mg de AH por infiltración y una concentración al 2 % respecto a Synvisc One®, que tiene un volumen de 6 ml, 48 mg de AH por infiltración y una concentración del 0,8 %.
Origen: Adant® Plus es de origen biotecnológico, mientras que Synvisc One es de origen animal.
Estructura: Adant® Plus es de estructura no reticulada y el Synvisc One es reticulado.
Peso Molecular: Adant® Plus tiene un peso molecular medio (1.000 KDa), y el Synvisc One® es de peso molecular alto (6.000 KDa).
Composición: Adant® Plus es un hialuronato sódico de origen biotecnológico y el Synvisc One® está compuesto por hilanos.
Discusión
La revisión de los IFU de los AH muestra que existen más de 40 AH intrarticulares comercializados en España y que no todos los AH cuentan con fichas técnicas o IFU estructuradas, accesibles y que especifiquen la información esencial para poder evaluarlos.
El AH es una opción terapéutica segura para tratar la OA de rodilla en ciertas circunstancias según las guías clínicas. Sin embargo, la elección del tipo de AH a utilizar no se recoge en estas guías. Este trabajo pone de manifiesto que existe información en las fichas técnicas como el peso molecular, la estructura, el origen, la duración del efecto, el volumen, la cantidad de AH por infiltración y las indicaciones aprobadas, que puede ser de ayuda a la hora de seleccionar el AH.
Los AH de larga duración son una buena opción, especialmente en momentos de sobresaturación del sistema sanitario, como el actual, debido a la sobrecarga asistencial por la pandemia de COVID-19.
Entre los AH one shot comercializados en España, solo Adant® Plus y Synvisc One® reflejan en su ficha técnica una duración del efecto de 12 meses.
Segunda fase: revisión de AH one shot con ensayos clínicos con seguimiento superior a 6 meses
En esta segunda fase analizamos los resultados de los ensayos clínicos de estos productos one shot, que sobrepasan los 6 meses de seguimiento, para intentar dilucidar cuáles de ellos tienen evidencia clínica de 1 año de duración, aunque no aparezca en su ficha técnica.
Evidencia clínica de ácidos hialurónicos one shot con estudios de seguimiento mayor a 6 meses
Estos estudios de largo seguimiento se analizan a continuación (Tabla V), donde se plasma la descriptiva general de cada estudio y sus objetivos (18-25).
Si realizamos una revisión de los resultados en la literatura (18-25), solo encontramos que Adant® Plus y Synvisc One® han demostrado una duración del efecto de 12 meses a través de estudios de largo seguimiento (> 6 meses). Adant® One, Crespine®Gel+ precisarían, por lo tanto, de reinfiltración alrededor de los 6-8 meses. Y por último, Durolane® e Hyalone® no demuestran una duración superior a 6 meses en un número significativo de pacientes (Tabla V).
Analizando la evidencia recogida respecto a la duración de acción de estos productos, encontramos:
1. Durolane®: se localiza un primer estudio publicado, aleatorizado, controlado, de 48 semanas de seguimiento con 1 infiltración de Durolane® versus 3 infiltraciones de plasma rico en plaquetas (PRP) en OA de rodilla.
La inyección de PRP es significativamente más eficaz que Durolane® para reducir el componente de dolor, rigidez y mejorar la función física (20). Solo un 17-27 % de los pacientes tratados con Durolane® obtuvieron una mejora del 30 % (WOMAC) a las 26 semanas, comparado con un 52-83 % para PRP. A las 48 semanas, esa mejoría se observó únicamente en un 2-17 % de pacientes tratados con Durolane® vs. 47-58 % de pacientes tratados con PRP.
Un segundo estudio (21) está dividido en una primera fase aleatorizada y doble ciego con 6 meses de seguimiento y una segunda abierta, con seguimiento hasta las 52 semanas. En este estudio, Leighton y cols. (21) demuestran que no hay diferencias significativas entre Durolane® y glucocorticoides (MPA) a las 12 semanas, aunque sí las hay a las 26 semanas, siendo Durolane® superior a MPA comparado con el estado basal.
En la fase abierta, solo 31 de los 221 pacientes del brazo con Durolane®, un 14 %, o un 19 % si consideramos solo los 163 pacientes que se mantenían en el estudio, no recibieron una segunda infiltración, por lo que el resultado no puede avalar una duración de acción de 12 meses dado el bajo porcentaje de pacientes que recibieron solo una infiltración. En línea con la publicación de Vaquerizo y cols. (20) y Leighton y cols. (21) la ficha técnica de Durolane® indica una duración de 6 meses.
2. Hyalone®: estudio aleatorizado, controlado (12 meses) de 1 infiltración Hyalone® vs. Hyalone + células madre en OA de rodilla.
La combinación de Hyalone® con células madre es más efectiva y duradera, sin observarse efectividad de Hyalone® en monoterapia más allá de los 6 meses (22). Los pacientes tratados con la combinación de células madre y Hyalone® mejoraron sus síntomas hasta 12 meses después de tratamiento. No hubo diferencias significativas respecto al estado basal a los 12 meses en pacientes tratados solo con Hyalone®. Hyalone® no indica la duración del efecto en su ficha técnica.
3. Crespine®Gel+: estudio no aleatorizado, abierto, de 9 meses de seguimiento con 1 infiltración Crespine® Gel+ en OA de rodilla (I-VI).
Crespine®Gel+ tiene una duración del efecto demostrada de 6-8 meses. El pico de respuesta de Crespine®Gel+ para el componente de dolor fue a los 5 meses y para el componente de rigidez fue a los 8 meses. Un 40 % de los pacientes sufrió dolor después de la infiltración y requirieron de tratamiento con analgésicos durante 2-3 días.
En línea con la publicación de Bashaireh y cols. (19), la ficha técnica de Crespine®Gel+ no indica una duración de acción concreta.
4. Synvisc One®: dispone de dos estudios de 52 semanas de seguimiento, uno multicéntrico abierto (23) y otro observacional (24) con 1 infiltración de Synvisc One® en OA de rodilla (I-III).
Synvisc One® es efectivo a largo plazo y mantiene una respuesta positiva hasta el mes 12. Hubo mejoras significativas en todas las semanas de seguimiento respecto al estado basal del paciente (23,24). A la semana 12, toda la puntuación WOMAC había mejorado ~20 % y a la semana 52 se veía una mejora de ~30 % (23). Al mes 6, toda la puntuación WOMAC había mejorado ~42 % y al mes 12 había una mejora del ~44 % (24). Un 2,5 % (23) y un 4,5 % (24) de pacientes precisó una reinfiltración de Synvisc One® después del mes 6 del estudio. Alrededor de un 60 % de evaluadores y pacientes describió la situación del paciente como buena/muy buena 12 meses después del tratamiento con Synvisc One® (23). En línea con sus publicaciones, la ficha técnica de Synvisc One® describe una duración de 52 semanas.
5. Adant® One: estudio prospectivo, abierto (12 meses) de 1 infiltración Adant® One en OA de rodilla (II-VI).
El efecto de Adant® One tiene una duración del efecto de alrededor 7-12 meses (18). 12 meses después de la infiltración con Adant® One la mejoría aún se notaba en > 40 % de los pacientes. El 50 % de los pacientes precisó una reinfiltración de Adant® One, siendo el tiempo medio de reinfiltración de 7,2 meses.
En línea con la publicación de Rodrigo Royo y cols. (18) la ficha técnica de Adant® One indica que una segunda infiltración de Adant® One puede ser necesaria después de 6 meses.
6. Adant® Plus: estudio multicéntrico, prospectivo y abierto de 12 meses de seguimiento con 1 infiltración Adant® Plus en OA de rodilla (II-III) (25).
Las conclusiones que se pueden extraer de este estudio de largo seguimiento es que la duración del efecto de Adant® Plus se sitúa en 12 meses para la mayoría de los pacientes. Tanto a los 6 meses como a los 12 meses se observó una reducción del dolor significativa del 36 % respecto al estado basal del paciente (p < 0,0001). La mejoría no fue únicamente en el componente del dolor, sino que también fue significativa en reducción de la rigidez (35 %; p < 0,0001) y mejora de la función articular (39 % p < 0,0001). Solamente un 14 % de los pacientes precisó una reinfiltración de Adant® Plus en el mes 6 del estudio. La mayoría de los evaluadores y pacientes describió la situación del paciente como buena o muy buena 12 meses después del tratamiento con Adant® Plus.
En línea con esta publicación, la ficha técnica de Adant® Plus describe una duración de 12 meses tras una sola infiltración para la mayoría de los pacientes.
Conclusiones
Adant® Plus y Synvisc One® son los únicos AH one shot comercializados en España con una duración del efecto demostrada de 12 meses, tal y como indica su ficha técnica. Entre ellos existen importantes diferencias:
— Origen (seguridad): el origen es un factor que influye en el perfil de seguridad del producto y es un punto clave diferenciador (29). Adant® Plus es de origen biotecnológico y Synvisc One® es de origen animal. Los AH de origen animal presentan más efectos adversos locales como artritis pseudosépticas o dolor postinyección (39,40).
— Estructura: Synvisc One® presenta una estructura reticulada, mientras que Adant® Plus no. La reticulación ha demostrado en estudios en animales e in vitro una mayor duración del AH en la articulación, pero esta mayor permanencia no se ha podido correlacionar con un mejor resultado funcional en los estudios clínicos. Los polímeros utilizados para realizar la reticulación pueden ser menos biocompatibles que el AH exógeno y condicionar mayores efectos adversos (41,42).
— Indicaciones: Synvisc One® tiene indicación en rodilla; mientras que Adant® Plus en rodilla y el resto de articulaciones sinoviales.
La información de las fichas técnicas o IFU de los productos sanitarios se basa en estudios propios del producto comercializado y, como se ha expuesto, los resultados de un producto de AH no deben ser extrapolados al resto.
Los metanálisis realizados hasta la fecha comparando AH de diferente PM no encontraron diferencias en términos de eficacia (43,44). Sin embargo, se observó que los riesgos de acontecimientos adversos (AA) locales y erupciones posteriores a la inyección eran mayores con los hilanos que con el AH de PM bajo o medio (41). Se ha informado también un mayor número de casos de artritis pseudoséptica con los hilanos que con otras preparaciones de AH, y que este riesgo podría aumentar con los ciclos posteriores (39,40).
Son necesarios estudios comparativos a largo plazo de los distintos productos de AH para poder establecer con mayor exactitud cuál de estos productos es más beneficioso para nuestros pacientes, así como para establecer el mejor paciente diana y poder arrojar más luz sobre cuáles de las características diferenciadas de estos productos son las que tienen una verdadera relevancia sobre su eficacia.
Conflicto de intereses
FJB declara financiación para proyectos de investigación Sanofi-Aventis, Lilly, BMS, Amgen, Pfizer, AbbVie, TRB Chemedica International, GlaxoSmithKline, Archigen Biotech Limited, Novartis, Nichi-iko pharmaceutical Co, Genentech, Janssen Research & Development, UCB Biopharma, Centrexion Therapeutics, Celgene, Roche, Regeneron Pharmaceuticals Inc, Biohope, Corbus Pharmaceutical, Meiji Pharma, Kiniksa Pharmaceuticals, Ltd, Gilead Sciences, Inc. CG and MAC declaran financiación de Meiji Pharma. JFC declara financiación para proyectos de investigación de Ipsen y Merz Pharma.
BIBLIOGRAFÍA
1. Espinosa-Morales R, Alcántar-Ramirez J, Arce-Salinas C, Chávez-Espina LM, Esqui-vel-Valerio JA, Gutiérrez Gómez JJ, et al. Multidisciplinary meeting of experts for di-agnosis and treatment of osteoarthritis. Up to date based on evidence. Med Int Mex. 2018;34(3):443-76.
2. Bruyère O, Honvo G, Veronese N, Arden NK, Branco J, Curtis EM, et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthri-tis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum. 2019;49(3):337-50. DOI: 10.1016/j.semarthrit.2019.04.008.
3. Seoane-Mato D, Sánchez-Piedra C, Silva-Fernández L, Sivera F, Blanco FJ, Pérez Ruiz F, et al. Prevalencia de enfermedades reumáticas en población adulta en España (estudio EPISER 2016). Objetivos y metodología. Reumatol Clin. 2019;15(2):90-96. DOI: 10.1016/j.reuma.2017.06.009.
4. Blanco FJ, Silva-Díaz M, Quevedo-Vila V, Seoane-Mato D, Pérez Ruiz F, Juan-Mas A,et al. Prevalencia de artrosis sintomática en España: Estudio EPISER2016. Reumatol Clin. 2021;17(8):461-70. DOI: 10.1016/j.reuma.2020.01.008.
5. Altas, estancia media (días) y coste medio (€) de los procesos obstétricos y quirúr-gicos más frecuentes de hospitalización. Hospitales de Agudos. SNS. Año 2019 [Internet]. Ministerio de Sanidad; 2019. Disponible en: https://www.sanidad.gob.es/estadEstudios/estadisticas/docs/CMBD/Costes_proc_obst_quir_mas_frec_2019.pdf.
6. Loza E, López-Gómez JM, Abasolo L, Maese J, Carmona L, Batlle-Gualda E; Artrocad Study Group. Economic burden of knee and hip osteoarthritis in Spain. Arthritis Rheum. 2009;61(2):158-65. DOI: 10.1002/art.24214.
7. Ong, KL, Niazi F, Lau E, Mont MA, Concoff A, Shaw P, et al. Knee OA cost comparison for hyaluronic acid and knee arthroplasty. J Orthop Surg Res. 2020;15(1):305. DOI: 10.1186/s13018-020-01848-7.
8. Vasavilbaso-Trueba C, Rosas-Bello CD, Medina-López E, Coronel Granado MP, Navarrete Álvarez JM, Trueba Davalillo CA, et al. Benefits of different postoperative treatments in patients undergoing knee arthroscopic debridement. Open Access Rheumatol. 2017;9:171-9. DOI: 10.2147/OARRR.S138353.
9. Raman R, Henrotin Y, Chevalier X, Migliore A, Jerosch J, Montfort J, et al. Decision Algorithms for the Retreatment with Viscosupplementation in Patients Suffering from Knee Osteoarthritis: Recommendations from the EUROpean VIScosupple-mentation COnsensus Group (EUROVISCO). Cartilage. 2018;9(3):263-75. DOI: 10.1177/1947603517693043.
10. Mar J, Romero-Jurado A, Arrospide A, Enrique-Fidalgo A, Soler-López B. Análisis de costes del tratamiento con viscosuplementación con ácido hialurónico estabilizado en pacientes con artrosis de rodilla candidatos a implantación de prótesis. Rev Esp Cir Ortop Traumatol. 2013;57(1):6-14.
11. Conrozier T, Monfort J, Chevalier X, Raman R, Richette P, Diraçoglù D, et al. EUROVISCO Recommendations for Optimizing the Clinical Results of Viscosupplementation in Osteoarthritis. Cartilage. 2020;11(1):47-59. DOI: 10.1177/1947603518783455.
12. Navarro-Sarabia F, Coronel P, Collantes E, Navarro FJ, de la Serna AR, Naranjo A, et al. A 40-month multicentre, randomised placebo-controlled study to assess the effi-cacy and carry-over effect of repeated intra-articular injections of hyaluronic acid in knee osteoarthritis: The AMELIA project. Ann Rheum Dis. 2011;70(11):1957-62. DOI: 10.1136/ard.2011.152017.
13. Navarro-Sarabia F, Coronel P, Blanco F, et al. Efficacy and safety of longterm repeated, intraarticular injections of hyaluronic acid in knee osteoarthritis: final results of the AMELIA trial. Osteoarthr Cartil. 2012;20(1):S28-S29. Poster nº37. DOI: 10.1016/j.joca.2012.02.550.
14. Bannuru R, Osani MC, Vaysbrot E, Arden NK, Bennell K, Bierma-Zeinstra SMA, et al. OARSI guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis. Osteoarthr Cartil. 2019;27(11):1578-89. DOI: 10.1016/j.joca.2019.06.011.
15. Miller LE, Block JE. US-Approved Intra-Articular Hyaluronic Acid Injections are Safe and Effective in Patients with Knee Osteoarthritis: Systematic Review and Meta-Analysis of Randomized, Saline-Controlled Trials. Clin Med Insights Arthritis Mus-culoskelet Disord. 2013;6:57-63.
16. Vibeke S, McIntyre LF, Beach WR, Miller LE, Block JE. Safety and efficacy of US-approved viscosupplements for knee osteoarthritis: a systematic review and me-ta-analysis of randomized, saline-controlled trials. J Pain Res. 2015;8:217-28.
17. Altman RD, Akermark C, Beaulieu AD, Schnitzer T, Durolane International Study Group. Efficacy and safety of a single intra-articular injection of non-animal stabi-lized hyaluronic acid (NASHA) in patients with osteoarthritis of the knee. Osteo-arthr Cartil. 2004;12(8):642-9. DOI: 10.1016/j.joca.2004.04.010.
18. Rodrigo-Royo M, Quero-López J, Aparicio-Abiol RM, Cía-Blasco P, Baltanás-Rubio P, Acín-Lázaro MP. Eficacia de las inyecciones intraarticulares de ácido hialurónico pa-ra el tratamiento de la artrosis de rodilla: resultados de una serie de casos tratados en una unidad del dolor. Rev Soc Esp Dolor. 2017;24:16-26. DOI: 10.20986/resed.2016.3485/2016.
DOI: 10.20986/resed.2016.3485/2016.
19. Bashaireh K, Naser Z, Hawadya KA, Sorour S, Al-Khateeb RN. Efficacy and safety of cross-linked hyaluronic acid single injection on osteoarthritis of the knee: A post-marketing phase IV study. Drug Des Devel Ther. 2015;9:2063-72. DOI: 10.2147/DDDT.S81524.
20. Vaquerizo V, Plasencia MA, Arribas I, Seijas R, Padilla S, Orive G, et al. Comparison of intra-articular injections of plasma rich in growth factors (PRGF-Endoret) versus Durolane hyaluronic acid in the treatment of patients with symptomatic osteoar-thritis: A randomized controlled trial. Arthroscopy. 2013;29(10):1635-43. DOI: 10.1016/j.arthro.2013.07.264.
21. Leighton R, Akermark C, Therrien R, Richardson JB, Andersson M, Todman MG, et al. NASHA hyaluronic acid vs methylprednisolone for knee osteoarthritis: A pro-spective, multi-centre, randomized, non-inferiority trial. Osteoarthr Cartil. 2014;22(1):17-25. DOI: 10.1016/j.joca.2013.10.009.
22. Lamo-Espinosa JM, Mora G, Blanco JF, Granero-Moltó F, Nuñez-Córdoba JM, Sán-chez-Echenique C, et al. Intra-articular injection of two different doses of autolo-gous bone marrow mesenchymal stem cells versus hyaluronic acid in the treat-ment of knee osteoarthritis: multicenter randomized controlled clinical trial (phase I/II). J Transl Med. 2016;14(1):246. DOI: 10.1186/s12967-016-0998-2.
23. Pal S. Thuppal S, Reddy JK, Avasthi S, Aggarwal A, Bansal H, et al. Long-term (1 year) safety and efficacy of a single 6mL injection of Hylan G-F 20 in Indian pa-tients with symptomatic knee osteoarthritis. Open Rheumatol J. 2014;8:54-68. DOI: 10.2174/1874312901408010054.
24. Kearey P, Popple AE, Warren J, Davis T, Bellamy N, LOBRAS Study Group. Im-provement in condition-specific and generic quality of life outcomes in patients with knee osteoarthritis following Synvisc-One: Results from the LOBRAS study. Curr Med Res Opin. 2017;33(3):409-19. DOI: 10.1080/03007995.2016.1260533.
25. Gavín C, Blanco FJ, Pablo JL, Caracuel MA, Rosas J, Gómez-Barrena E, et al. One-Year, Efficacy and Safety Open Label Study, with a Single Injection of a New Hyalu-ronan for Knee OA: The SOYA Trial. J Pain Res. 2021;14:2229-37. DOI: 10.2147/JPR.S321841.
26. Castellano J, Pérez A. Evidencia de la eficacia del ácido hialurónico intraarticular en el tratamiento de la artrosis de rodilla. Rev Soc Val Reuma. 2007;2(2):61-2.
27. Estades-Rubio FJ, Reyes-Martín A, Morales-Marcos V, García-Piriz M, García-Vera JJ, Perán M, et al. Knee viscosupplementation: Cost-effectiveness analysis between stabilized hyaluronic acid in a single injection versus five injections of standard hyaluronic acid. Int J Mol Sci. 2017;18(3):658. DOI: 10.3390/ijms18030658.
28. Akermark C, Berg P, Bjorkman A, Malm P. Non-animal stabilised hyaluronic acid in the treatment of osteoarthritis of the knee –a tolerability study. Clin Drug Invest. 2002;22(3):157-66. DOI: 10.2165/00044011-200222030-00002.
29. Arias-Pou P, Delgado-Latorre A, Aguinagalde-Toya A, Gaspar-Carreño M, Silber-berg-Muiño J, Sobrido-Sampedro C. Presentaciones de ácido hialurónico ¿son realmente diferentes? Ofil Ilaphar. 2018;28(3):265-73.
30. Borrás-Verdera A, Calcedo-Bernal V, Ojeda-Levenfeld J, Clavel-Sainz C. Eficacia y seguridad de una única inyección intraarticular de ácido hialurónico al 2 % más mani-tol en artrosis de rodilla durante un periodo de 6 meses. Rev Esp Cir Ortop Trauma-tol. 2012;56(4):274-80. DOI: 10.1016/j.recot.2012.02.004.
31. Aviad AD, Houpt JB. The molecular weight of therapeutic hyaluronan (sodium hya-luronate): how significant is it? J Rheumatol. 1994;21(2):297-301.
32. Polache-Vengud J, Selva-Otaolaurruchi J, Cortés-Botella J, García-Salom P, García-Monsalve A. Viscosuplementación: revisión de los diferentes hialuronatos en Es-paña. Farm Hosp. 2000;24(6):371-6.
33. Raman R, Dutta A, Day N, Sharma HK, Shaw CJ, Johnson GV. Efficacy of Hylan G-F 20 and Sodium Hyaluronate in the treatment of osteoarthritis of the knee — a pro-spective randomized clinical trial. Knee. 2008;15(4):318-24. DOI: 10.1016/j.knee.2008.02.012.
34. Wobig M, Bach G, Beks P, Dickhut A, Runzheimer J, Schwieger G, et al. The role of elastoviscosity in the efficacy of viscosupplementation for osteoarthritis of the knee: a comparison of hylan G-F 20 and a lower-molecular-weight hyaluronan. Clin Ther. 1999;21(9):1549-62. DOI: 10.1016/S0149-2918(00)80010-7.
35. Atamaz F, Kirazli Y, Akkoc Y. A comparison of two different intra-articular hyalu-ronan drugs and physical therapy in the management of knee osteoarthritis. Rheu-matol Int. 2006;26(10):873-8. DOI: 10.1007/s00296-005-0096-x.
36. Gigis I, Fotiadis E, Nenopoulos A, Tsitas K, Hatzokos I. Comparison of two different molecular weight intra-articular injections of hyaluronic acid for the treatment of knee osteoarthritis. Hippokratia. 2016;20(1):26-31.
37. Jüni P, Reichenbach S, Trelle S, Tschannen B, Wandel S, Jordi B, et al. Efficacy and safety of intraarticular hylan or hyaluronic acids for osteoarthritis of the knee: A randomized controlled trial. Arthritis Rheum. 2007;56(11):3610-9.
DOI: 10.1002/art.23026.
38. Mongkhon JM. Thach M, Shi Q, Fernandes JC, Fahmi H, Benderdour M. Sorbitol-modified hyaluronic acid reduces oxidative stress, apoptosis and mediators of in-flammation and catabolism in human osteoarthritic chondrocytes. Inflamm Res. 2014;63(8):691-701. DOI: 10.1007/s00011-014-0742-4.
39. Chen AL, Desai P, Adler EM, Di Cesare PE. Granulomatous inflammation after Hylan G-F 20 viscosupplementation of the knee: a report of six cases. J Bone Joint Surg Am 2002;84(7):1142-7. DOI: 10.2106/00004623-200207000-00008.
40. Altman RD, Bedi A, Karlsson J, Sancheti P, Schemitsch E. Product differences in in-tra-articular hyaluronic acids for osteoarthritis of the knee. Am J Sports Med. 2016;44(8):2158-65. DOI: 10.1177/0363546515609599.
41. Reichenbach S, Blank S, Rutjes AWS, Shang A, King EA, Dieppe PA, et al. Hylan ver-sus hyaluronic acid for osteoarthritis of the knee: a systematic review and metaa-nalysis. Arthritis Rheum. 2007;57(8):1410-8. DOI: 10.1002/art.23103.
42. Yoshioka K, Katayama M, Nishiyama T, Harada K, Takeshita S, Kawamata Y. Bio-compatibility study of different hyaluronan products for intra-articular treatment of knee osteoarthritis. BMC Musculoskelet Disord. 2019;20(1):424. DOI: 10.1186/s12891-019-2815-6.
43. Trojian TH, Concoff AL, Joy SM, Hatzenbuehler JR, Saulsberry WJ, Coleman CI. AMSSM scientific statement concerning viscosupplementation injections for knee osteoarthritis: importance for individual patient outcomes. Clin J Sport Med. 2016;26(1):1-11. DOI: 10.1097/JSM.0000000000000274.
44. Dai WL, Lin ZM, Guo DH, Shi ZJ, Wang J. Efficacy and Safety of Hylan versus Hyalu-ronic Acid in the Treatment of Knee Osteoarthritis. J Knee Surg. 2019;32(3):259-68. DOI: 10.1055/s-0038-1641142.