Introducción
El objetivo del presente trabajo es revisar artículos académicos, con el fin de unificar conceptos sobre presentación clínica, criterios diagnósticos y opciones terapéuticas para SDRC.
Su metodología ha sido la búsqueda bibliográfica de artículos académicos en bibliotecas científicas desde 2010. Los buscadores utilizados han sido: PubMed, Schoolar google, Cochrane. Las palabras clave: Sudeck, SDRC, causalgia, distrofia simpática refleja.
En la Asociación Argentina para el Estudio del Dolor (AAED), capítulo de la Asociación Internacional para el Estudio del Dolor (IASP), estamos comprometidos en la divulgación de todos los avances científicos para el diagnóstico y el tratamiento del dolor. Con esta orientación, el Grupo de Interés Especial en Síndrome Doloroso Regional Complejo ha realizado una extensa investigación de una entidad muchas veces no diagnosticada a tiempo con múltiples complicaciones y que, a pesar de los avances en la comprensión de la compleja neurobiología del dolor, el tratamiento de este síndrome sigue siendo insuficiente.
Historia y prevalencia
A lo largo de la historia, este síndrome ha sido descrito por distintos autores. Los primeros casos descriptos datan del siglo XIV, en el cual el cirujano Ambrose Pare hizo referencia a un tratamiento de un síndrome doloroso persistente después de haber realizado una flebotomía del miembro afectado. En 1851, Claude Bernard describe por primera vez un síndrome doloroso secundario a cambios en el sistema nervioso simpático; en 1864, Silas Weir Mitchell realizó una publicación sobre pacientes con heridas de armas de fuego, los cuales presentaron posteriormente un síndrome caracterizado por dolor quemante acompañado de edema, cambios en la coloración, temperatura de la piel, hiperalgesia y rigidez articular al cual se denominó causalgia. Al inicio del siglo XX Sudeck reportó cuadros clínicos con signos y síntomas compatibles con esta entidad. En 1946, Evans acuñó el término distrofia simpática para referirse a estas entidades. En 2001, la IASP acepta el término síndrome doloroso regional complejo propuesto por Schott (1,2).
En cuanto a la incidencia de esta patología, las cifras expuestas son muy variables dependiendo la población y países estudiados. Los valores van desde 5,47-26,2 casos por cada 10.000 personas, observándose mayor incidencia en mujeres (en una relación 3:1) y siendo la edad media de presentación 45 años. El 85 % de los casos son de tipo 1 y solo el 13 % son tipo 2 (1).
El 5-10 % de los SDRC se desarrollan de forma espontánea, aproximadamente el 10 % tras un trauma menor, aunque puede aparecer después de cualquier lesión. Los antecedentes más comunes son fracturas y cirugías (40 %), lesiones radiculares (9 %), lesiones medulares (6 %), contractura de Dupuytren, esguinces y lesiones por aplastamiento (3-6).
Una revisión sistemática en 2014 reveló resultados mixtos para explicar el pronóstico del SDRC. Los autores concluyeron que algunos síntomas (dolor, hinchazón, decoloración y cambios de temperatura) se resuelven entre 6 y 13 meses después del inicio de los síntomas, mientras que otros síntomas (cambios motores y funcionales) tienden a ser de naturaleza crónica (> 1 año). Los autores especulan que quizás las intervenciones tempranas pueden estar correlacionadas con una resolución más temprana de los síntomas (2).
El SDRC tipo I es un síndrome doloroso que aparece tras un evento nocivo, con dolor espontáneo, alodinia y/o hiperalgesia, edema, alteración del flujo sanguíneo cutáneo o alteraciones sudomotoras sin lesión nerviosa evidente. El SDRC tipo II es similar, pero en él existe una lesión nerviosa total o parcial previa y evidente (4-6).
Fisiopatología
Si bien su fisiopatología no está del todo definida, el modelo más aceptado incluye tres mecanismos: disfunción autonómica, inflamación postraumática y sensibilización central.
Disfunción autonómica
Este mecanismo se explica por el aumento de la expresión de receptores alfa 1 adrenérgicos en los vasos de los miembros afectados, la alteración en la circulación de catecolaminas y aumento de la sensibilidad a las mismas. Se identifican tres patrones clínicos en la evolución del síndrome: inicialmente hay una disminución en la circulación de norepinefrina conduciendo a la vasodilatación, edema y aumento de la temperatura de la piel; posteriormente ante la persistencia de la desregulación simpática aumenta la sensibilidad periférica a catecolaminas con la subsecuente vasoconstricción llevando a hiperhidrosis y disminución de la temperatura (1,7).
Inflamación postraumática
En este síndrome se vio un aumento del péptido relacionado con el gen de la calcitonina y de la sustancia P, los cuales serían los responsables del aumento en la hiperexcitabilidad neuronal. El fenómeno de hiperalgesia se correlaciona con el aumento del factor de necrosis tumoral y de interleuquina 6 (1).
Sensibilización central
En el proceso de sensibilización central se da una disminución del flujo inhibitorio al SNC, prevaleciendo la facilitación de las vías excitatorias que proyectan a la médula. Las regiones cerebrales involucradas en la modulación intrínseca del estímulo, o también llamado flujo inhibitorio, incluyen a la corteza somatosensorial, el hipotálamo, el mesencéfalo, al sustancia gris periacueductal y el rafe magnus. El sistema descendente tiene tres componentes mayores, interrelacionados funcionalmente el sistema opioide, el sistema noradrenérgico y el sistema serotoninérgico. El sistema opioide integrado por los precursores opiáceos y sus respectivos péptidos está presente en la amígdala, el hipotálamo, la sustancia gris periacueductal, el rafe magnus y el asta posterior. Las neuronas noradrenérgicas se proyectan desde el locus coeruleus y otras células noradrenérgicas hasta el asta posterior, a través del cordón dorsolateral. La estimulación de estas áreas produce analgesia, al igual que la administración directa o intratecal de agonistas de los receptores alfa 2. En el sistema serotoninérgico, las neuronas del rafe magnus contienen serotonina y envían sus proyecciones a la médula por el cordón dorsolateral. Durante este proceso, además, se genera una mala adaptación de los fenómenos de plasticidad neuronal que explica los cambios en el tono del miembro afectado. Otro de los mecanismos que explican esta teoría fisiopatológica son los cambios en la organización somatotópica en la corteza somato sensorial, en donde se pueden observar una disminución de la representación del miembro afectado en el área cortical (1,7,8).
Respuesta inmunológica
Se ha propuesto que el síndrome de dolor regional complejo (SDRC) es una enfermedad autoinmune postraumática. Los estudios de preparaciones de Ig G agrupadas de cohortes de pacientes (n = 26-27) muestran que los autoanticuerpos patológicos están presentes en la población más amplia de pacientes con SDRC persistente, y que los pacientes con dolor más severo tienen títulos de autoanticuerpos efectivos más altos que los pacientes con dolor de intensidad moderada. La hipersensibilidad dolorosa en el SDRC persistente es mantenida por autoanticuerpos, que actúan sensibilizando a los nociceptores A y C (9,10).
Factores psicológicos
La Asociación Internacional para el Estudio del Dolor (IASP) define al dolor como “una experiencia sensorial y emocional desagradable asociada con el daño tisular actual o potencial, o descrito en términos de dicho daño”. Esta descripción aceptada para entender el dolor deja en claro que la percepción del mismo está lejos de ser un evento puramente nociceptivo. La respuesta negativa asociada al dolor agudo nos permitió a los humanos aprender rápidamente a evitar situaciones que nos exponen al peligro, pero cuando esta respuesta se perpetúa en el tiempo, como es en los casos de dolor crónico, genera un aislamiento y enfoque casi total al dolor. Esto último influye sobre la respuesta al tratamiento y la calidad de vida de los pacientes (11).
Factores étnicos-culturales y biológicos
Las creencias y costumbres compartidas por una comunidad influyen en la concepción de los pensamientos en torno a diferentes sensaciones, por ejemplo el dolor. Esto va a verse reflejado en el relato de las personas en torno al dolor, su nivel de urgencia en la consulta, su tolerancia al fallo terapéutico, su posición frente a la autoridad, su respuesta al contacto físico, como ocurre durante el examen físico, su mirada frente al sexo del proveedor de salud, etc. Por otro lado se vieron variaciones en la percepción/manifestación de dolor entre el género biológico femenino y masculino; esto puede estar asociado tanto a factores biológicos (“numerosos estudios han mostrado que las hormonas femeninas y sus fluctuaciones a través de etapas de la vida o durante el mes, desempeñan un papel sustancial en la percepción del dolor”), sociales y psicológicos (mayores estrategias de manifestación y adaptación al dolor por parte de las mujeres que de los hombres) (11).
Clínica
Los síntomas en el SDRC son desproporcionados a la lesión inicial. En el 95 % de los pacientes, los síntomas afectan a tejidos no dañados por la lesión inicial. Los signos y síntomas en el SDRC no se limitan a la zona de inervación de un solo nervio y muestran una distribución generalizada distalmente, y en algunos casos pueden manifestarse proximalmente o afectar a toda la extremidad.
Los pacientes pueden presentar varios signos y síntomas. Los más importantes, según su frecuencia son: hiperestesia, alodinia, hiperalgesia, dolor, hipoestesia, déficit sensorial, trastorno hemisensorial, desmineralización ósea, alteraciones tróficas, cambios cutáneos (hiperqueratosis, piel brillante, fibrosis, palidez, cambios ungueales, de temperatura y coloración, atrofia muscular) (12,13). La osteoprotegerina (OPG) es importante para la remodelación ósea y puede contribuir a la fisiopatología del síndrome de dolor regional complejo (SDRC). Recientemente se informó aumento de osteoprotetegerina en pacientes con SDRC.
Otras características clínicas que se observan con menos frecuencia son mioclonías, debilidad muscular y atrofia, limitación de movilidad articular, temblores, distonía, espasmos, Dupuytren y otras contracturas, disfunción del detrusor y del esfínter urinario, fotofobia, dolor ocular y disminución de agudeza visual (14,15). Ciertos hallazgos sugieren que el procesamiento aberrante de la entrada nociceptiva en la región trigeminal-medular ipsilateral del tronco encefálico contribuye a la incomodidad visual en el CRPS (16).
Recientemente se estudió que la hiperalgesia en CRPS se extiende más allá de la extremidad afectada para abarcar otros sitios en el lado ipsilateral del cuerpo. Esta alteración homolateral también parece involucrar la visión y la audición. Los estímulos acústicos desencadenan un aumento del dolor en la extremidad afectada por el SDRC que, notablemente, es mayor cuando se presentan estímulos de sobresalto en el lado afectado. En conjunto, estas observaciones sugieren que la entrada auditiva activa las vías nociceptivas centrales hiperexcitables en el CRPS (17).
SDRC I
El dolor se expande a lo largo de la extremidad o migra a otras partes del cuerpo en casi el 70 % de los pacientes. Se vuelve bilateral y produce una “imagen de espejo” del dolor en hasta el 50 % de los casos.
SDRC II (causalgia)
Los síntomas típicos son ardor espontáneo, hiperalgesia y alodinia mecánica y fría; más intensos en el territorio del nervio periférico afectado, con menos tendencia a diseminarse que en el SDRC I. Cambios inflamatorios y distróficos, y deterioro de la función motora, pero más leves que en el SDRC I.
El dolor puede localizarse en el área de la lesión inicial incluso antes de diagnosticarse el SDRC. Cuando comienzan los signos el dolor pasa a ser difuso y profundo, y la inflamación se generaliza por la extremidad. Los factores agravantes suelen incluir la carga física, los estímulos dolorosos, el movimiento (por ejemplo, la terapia física), los cambios de temperatura ambientales o locales, y los aumentos en la presión hidrostática (cambios ortostáticos) (6,16).
Estadios
Bonica describió tres etapas o estadios en el SDRC:
— Estadio I: sin causa aparente o seguido de un evento. Presentan dolor difuso, tipo quemazón, en un miembro, de predominio nocturno que se intensifica con los movimientos. Se acompaña de edema, hiperhidrosis, trastornos de la sensibilidad y crecimiento rápido de vello y uñas. La piel está eritematosa con aumento de la temperatura. La duración aproximada de esta fase es de varios días a tres meses.
— Estadio II: hay una tendencia a la disminución del dolor y de los signos pseudoinflamatorios, con tendencia a la impotencia funcional. La piel se presenta fina y cianótica y existen cambios en las faneras: el crecimiento del vello se enlentece y las uñas aparecen agrietadas y friables. Pueden aparecer retracciones tendinosas y cápsulo-ligamentosas que limitan el balance articular. Duración aproximada de tres a seis meses.
— Estadio III: es el más severo, caracterizado por limitación de la movilidad. Los pacientes pueden presentar un síndrome hombro-mano, contractura de dedos, cambios tróficos cutáneos y ungueales y pueden aparecer movimientos involuntarios, espasmo muscular y pseudoparálisis. En la radiografía ósea se observa importante desmineralización. La aparición de trastornos psiquiátricos de tipo depresivo es relativamente frecuente. Duración más de seis meses o un año (18,19).
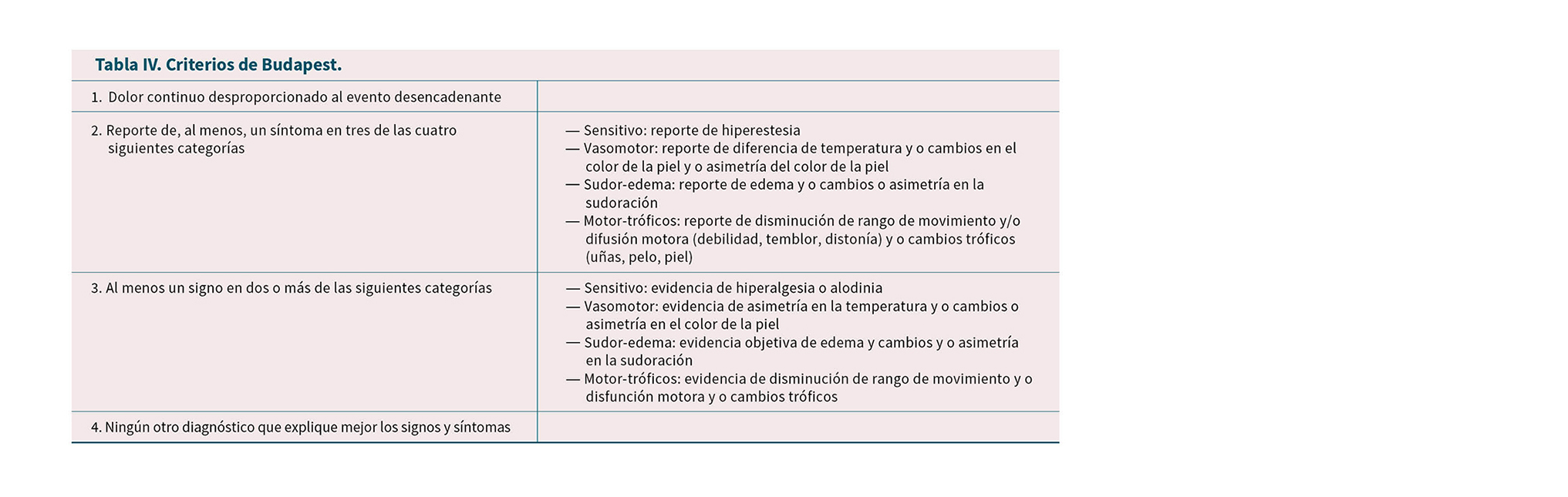
Actualmente los criterios más aceptados son los de IASP (Tabla I), estos últimos fueron revisados en 2007 (criterios de Budapest) encontrando que los mismos poseen una sensibilidad del 85 % y una especificidad del 69 %.
Diagnóstico SDRC
Los síntomas clínicos de SDRC incluyen dolor, pérdida sensitiva, síntomas motores, síntomas autonómicos y cambios tróficos de las extremidades afectadas. Hasta la actualidad no existe un estudio específico para el diagnóstico de SDRC, por lo cual se utilizan criterios clínicos para arribar al mismo. A lo largo de la historia se han desarrollado diferentes criterios con el objetivo de facilitar el diagnóstico y favorecer un tratamiento oportuno. Se identificaron 4 herramientas de diagnóstico validadas para su uso en adultos, ninguna validada en poblaciones pediátricas y ninguna herramienta de detección o screening para ningún grupo de edad.
Las 4 herramientas de diagnóstico identificadas incluyen los criterios de Veldman, los criterios de IASP, los criterios de Budapest y los criterios de investigación de Budapest. En el mismo año, se publicaron 2 conjuntos de criterios diagnósticos (los criterios IASP y los criterios de Veldman). Otro momento crítico fue la reunión de consenso de expertos celebrada por la IASP en Budapest en 2003, en la que los criterios anteriores de la IASP fueron reemplazados por los criterios de Budapest. Estos nuevos criterios eran más sólidos e incluían síntomas más diversos, particularmente con la adición de características motoras y tróficas. También hay otras 9 herramientas de diagnóstico que se excluyeron de esta revisión porque solo hubo un estudio que evaluó las propiedades de medición de la herramienta (Tabla I) (20-22).
Varios estudios sugieren que la intervención del diagnóstico temprano puede conducir a un resultado más favorable y potencialmente prevenir la discapacidad y la mala calidad de vida. La IASP reconoce la importancia del diagnóstico temprano y recomienda una evaluación rápida del SDRC agudo.
— Criterio de Veldman: los criterios de Veldman se publicaron por primera vez en 1993 para diagnosticar la distrofia simpática refleja. De acuerdo con estos criterios, se puede hacer un diagnóstico si: 1) 4 de 5 están presentes (dolor difuso inexplicable, diferencia en el color de la piel en relación con la otra extremidad, edema, diferencia en la temperatura de la piel en relación con la otra extremidad o rango de movimiento activo limitado); 2) aparición o aumento de los signos y síntomas anteriores después del uso; y 3) los signos y síntomas anteriores presentes en un área más grande que el área de la lesión/operación primaria e incluyendo el área distal a la lesión primaria (18).
— Criterio de la asociación internacional del estudio del dolor (IASP en inglís) (Tabla II y III): los criterios de la IASP para diagnosticar el SDRC se crearon por primera vez en una reunión de la IASP en Orlando en 1993 y luego se publicaron en 1994. De acuerdo con los criterios de la IASP, a un paciente se le diagnostica SDRC si cumple con los 4 criterios: 1) presencia de un inicio nocivo evento o causa de inmovilización; 2) dolor continuo, alodinia o hiperalgesia para los cuales el dolor es desproporcionado con respecto a cualquier evento desencadenante; 3) evidencia en algún momento de edema, cambios en el flujo sanguíneo de la piel o actividad sudomotora anormal en la región dolorosa; y 4) el diagnóstico está excluido por la existencia de condiciones que de otro modo explicarían el grado de dolor y disfunción (23).
— Criterios de investigación de Budapest (Budapest Research Criteria): estos criterios fueron introducidos por primera vez por Bruehl y cols. como una versión modificada de los criterios de la IASP, destinada a su uso en estudios de investigación para definir las poblaciones de estudio. Los criterios de Bruehl y cols. tienen 3 componentes para el diagnóstico: 1) dolor continuo, que es desproporcionado a cualquier evento desencadenante; 2) un síntoma en cada una de las 4 categorías; y 3) un signo en 2 de las 4 categorías; las categorías incluyen sensorial, vasomotor, sudomotor/edema y motor/trófico. Estos criterios se revisaron posteriormente para incluir un cuarto adicional, denominado Criterios de Investigación de Budapest (8). Los criterios agregados estipulan que ningún otro diagnóstico podría explicar mejor la presentación del paciente (24,25).
— Criterios de Budapest (Tabla IV): en 2003, la IASP celebró una conferencia de consenso en Budapest con el fin de mejorar los criterios diagnósticos de la IASP para el SDRC. Esta reunión resultó en la creación de los nuevos criterios, denominados criterios de Budapest. Estos criterios reflejaban en gran medida los criterios propuestos anteriormente por Harden y Bruehl en 1999. Los criterios de Budapest incluyen características motoras y tróficas de la enfermedad y más énfasis en los signos (es decir, observables por el médico). Los criterios de Budapest, destinados a fines clínicos, reflejan los criterios de investigación de Budapest con la excepción de una diferencia en la puntuación. Los criterios de Budapest son: 1) dolor continuo que es desproporcionado a cualquier evento desencadenante, 2) un síntoma en 3 de 4 categorías, y 3) un signo en 2 de 4 categorías; las categorías incluyen sensorial, vasomotor, sudomotor/edema y motor/trófico, y 4) ningún otro diagnóstico podría explicar mejor la presentación del paciente. Estos criterios fueron validados inicialmente en 2010 por Harden y cols., donde se compararon los criterios de Budapest con los criterios de la IASP para discriminar entre CRPS-1 y otros tipos de dolor neuropático. Este estudio concluyó que ambos criterios tenían una sensibilidad diagnóstica excelente (criterios IASP 100 % y criterios de Budapest 99 %), pero los criterios de Budapest tenían una especificidad superior (68 %) en comparación con los criterios IASP (41 %) (25,26).
Para clasificar el SDRC en tipo I y II se debe buscar la presencia de lesión nerviosa, la cual se encuentra presente en el tipo II. A través de la evaluación de la temperatura de la piel al inicio, se podrá dividir en SDRC caliente y SDRC frío. “El 70 % se presenta con SDRC caliente y el 30 % con SDRC frío, siendo el último el de peor pronóstico”.
El SDRC evoluciona en diferentes estadios; dentro de cada estadio los estudios complementarios poseen mayor o menor especificidad. Es importante comprender la fisiopatología y el cuadro clínico para seleccionar el estudio que brinde mayor información al momento de realizarlo. A continuación de desarrollarán brevemente los estudios complementarios disponibles:
— Gammagrafía: está indicada para los estadios I y II, presentando una sensibilidad y especificidad del 97 % y 86 %, respectivamente. Su principal indicación es para el diagnóstico precoz del SDRC, en fases iniciales se observa hipercaptación ósea intensa y precoz a nivel regional que sobrepasa los límites de la articulación afectada. Ocasionalmente, en fase tardía se puede observar hipocaptación del isótopo (27).
— RMN: es de utilidad para realizar un diagnóstico precoz y establecer diagnóstico diferencial con otras patologías. Las imágenes obtenidas son de interés, especialmente en los estadios clínicos I y III (27).
— TAC: una asimetría de flujo en la fase 1, 2 y/o 3 es sugerente de SDRC, aporta información relevante en diagnósticos complejos (coexistencia de alteraciones vasomotoras, afectación de tendones, ligamentos, cápsula articular y partes blandas). Se observa un área focal de osteoporosis asemejándose la imagen al queso suizo cuando la entidad se encuentra en estadio III. No es más sensible ni específica que la gammagrafía, con los inconvenientes de su mayor costo y la exposición del paciente a una dosis de radiación. No se aconseja como prueba diagnóstica. (27).
— Radiografía: es de utilidad en fases tardías, pudiéndose observar desmineralización ósea tras inmovilización. Presenta una sensibilidad y especificidad del 73 % y del 57 %. Genant y cols. establecieron 5 parámetros radiológicos. Otros autores describen un proceso regional que muestra una imagen unilateral de desmineralización de las metaepífisis de predominio subcondral, lesiones heterogéneas de tipo geódico y osteoporosis de intensidad variable, pudiendo afectarse articulaciones vecinas y del resto de la extremidad (Tabla V) (27).
— Otras pruebas: flebografía intraósea, Q- SART19 (se emplea como índice indirecto de la actividad simpática y registra para ello la producción del sudor), termografía (solo indicada en fase I), fluximetría cutánea por técnica doppler láser, bloqueo neural diferencial y electromiograma (indicado para diagnóstico de SDRC tipo II). La realización conjunta de termografía y Q-SART nos aporta una excelente información predictora de respuesta al bloqueo simpático, presentando un 94 % de sensibilidad y un 98 % de especificidad. La medición de la densidad ósea basada en ultrasonido puede utilizarse para mediciones repetidas en lugar de gammagrafía, detección de pérdida de la densidad ósea no invasiva y sin riesgo. También puede ser útil para analizar la cinética de la pérdida ósea después de la inmovilización en comparación con CRPS, así como para el seguimiento del tratamiento en el futuro (28,29).
Tratamiento
Hay varias opciones de tratamiento para el síndrome de dolor regional complejo (SDRC) que son regularmente utilizadas. Sin embargo, no hay un tratamiento específico al momento actual. Una vez arribado al diagnóstico es necesario iniciar el tratamiento inmediatamente con el objetivo de restaurar la función y evitar secuelas a largo plazo. Un abordaje interdisciplinario (farmacológico y no farmacológico) ha sido propuesto como protocolo en el manejo práctico (27,30).
Dentro de las terapias no farmacológicas, la fisioterapia, junto a la terapia ocupacional especialmente en los estadios iniciales, juegan un rol fundamental en la restauración funcional del miembro (27,31-33).
El movimiento del miembro afectado es importante para la restauración de la función. Los pacientes deben ser estimulados a utilizar el miembro afectado incluso ante la aparición de dolor (33,34).
Tratamientos fisioterápicos
— Terapia del espejo: es una técnica que se basa en la colocación de un espejo en el plano medio del paciente, de forma que se refleje la extremidad no parética y la imagen se superponga a la extremidad parética. Con esta colocación, se le solicita al sujeto que realice movimientos bilaterales y sincrónicos, mientras observa el reflejo que crea la ilusión de movimiento en el miembro parético. Es una buena herramienta para ser utilizada en conjunto con otras terapias (35-37).
— Imaginación motora gradual: este enfoque terapéutico involucra, primero el reconocimiento de las extremidades derecha e izquierda. En una segunda etapa, se introduce el movimiento imaginario y, generalmente, se realiza terapia en espejo. En estudios monocéntricos controlados, este enfoque ha sido efectivo; en un estudio multicéntrico, la efectividad no fue reproducida (37-41).
— Técnica de desensibilización: se utilizan diferentes texturas de manera gradual, desde texturas suaves a rugosas, comenzando por el miembro sano y continuando por el afectado (27,42).
— Hidroterapia: si es plausible de tolerar el agua, este tipo de terapia permite disminuir la gravedad y mejorar el movimiento en esta interfase (42).
— TENS: (estimulación eléctrica nerviosa transcutánea) han sido empleados para calmar el dolor en pacientes con SDRC I. Existen estudios de limitada calidad metodológica que señalan beneficios en estos pacientes con el uso de TENS (43).
— Kinesio-taping: es utilizado para disminuir el edema (42).
— Acupuntura: se menciona en muchas revisiones de tratamientos. Hay dos ECA que evalúan el tratamiento con acupuntura en pacientes con SDRC. Uno era muy pequeño (n = 14) y no logró mostrar una diferencia significativa en los resultados. El otro tenía un tamaño de muestra más grande (n = 96) e informó una mejoría en la gravedad del dolor y la función motora de las extremidades afectadas 40 días después del tratamiento en pacientes con CRPS tipo I después de un accidente cerebrovascular (nivel 2). Sin embargo, se necesita mucha más investigación para demostrar completamente la utilidad de la acupuntura en SDRC (44,45).
— Oxígeno terapia hiperbárica: la oxigenoterapia hiperbárica se evaluó en un ensayo controlado aleatorizado (ECA) de tamaño medio y produjo una disminución significativa del dolor y el edema en comparación con el “aire normal”. Si bien son intrigantes, estos hallazgos de una mayor oxigenación que tiene beneficios clínicos parecen algo contrarios a otros trabajos que sugieren que el SDRC puede verse afectado negativamente por un estrés oxidativo elevado. Estos hallazgos requieren replicación, y también será importante considerar las consideraciones de costo-beneficio de esta terapia, dado el costo del equipo requerido (46-49).
— Quiropraxia: hay estudios de casos que sugieren que la manipulación quiropráctica puede reducir el dolor y mejorar el rango de movimiento y función en pacientes con SDRC (50).
Tratamientos farmacológicos
El tratamiento debe ser individualizado según el estadio y características del paciente. Este se basa en la disminución del dolor, la rigidez articular, el reflejo vasomotor y las secuelas óseas y articulares (27).
— El paracetamol y los antinflamatorios no esteroideos suelen utilizarse como primera línea de tratamiento en la fase aguda y los últimos pueden estar indicados para tratar la inflamación, aunque la evidencia es insuficiente para recomendarlos como tratamiento eficaz del dolor.
Se carece de apoyo de investigación para la utilidad de los AINE en el SDRC, con un estudio que no muestra ningún valor analgésico en el tratamiento del SDRC. Los AINE específicos pueden ser más útiles que otros. El ketoprofeno, por ejemplo, puede tener efectos sustanciales contra la bradicinina y la prostaciclina, además del típico efecto antiprostaglandina. Los inhibidores selectivos de la ciclooxigenasa-2 (por ejemplo, celecoxib) no se han probado en el SDRC, aunque se ha informado anecdóticamente que son de alguna utilidad (51-53).
— Corticoides: aunque los corticoides han demostrado en varios ensayos un efecto beneficioso sobre el dolor, el edema y la movilidad en la fase aguda, su utilización es controvertida por sus efectos negativos sobre la masa ósea. Las pautas utilizadas pueden ser variables y podemos encontrar, según autores, desde prednisona 30 mg/día con reducción progresiva durante 12 semanas hasta dosis más potentes de 30-60 mg repartidos a lo largo del día con reducción progresiva en 2-4 semanas (54).
— Antidepresivos: amitriptilina y duloxetina son opciones terapéuticas. Poseen baja recomendación (55,56).
— Anticonvulsivantes: la gabapentina a dosis de 600-1800 mg/día durante las primeras 8 semanas puede mejorar significativamente el dolor en el SDRC, aunque no parece controlar otros síntomas como la hiperalgesia o la alodinia. Otras drogas como la pregabalina también es utilizada (57,58). La carbamazepina tiene un lugar tradicional en el tratamiento del dolor neuropático y está aprobada por la FDA para la neuralgia del trigémino. Un ECA preliminar con un diseño experimental que incluyó a varios pacientes con SDRC que respondieron al tratamiento con estimulador de la médula espinal (y el SCS apagado) indicó que 600 mg/día de carbamazepina, tomados durante 8 días, tenían cierta eficacia analgésica. La oxcarbazepina es un anticonvulsivo similar que a menudo reemplaza a la carbamazepina, porque tiene menos efectos adversos graves (específicamente supresión de la médula ósea o insuficiencia hepática). Los efectos adversos más comunes de la oxcarbazepina son dolores de cabeza, mareos y náuseas. La oxcarbazepina no se ha estudiado específicamente en el SDRC (59-62).
— Los bifosfonatos han demostrado mejorar los signos inflamatorios y la movilidad, aunque la dosis, tiempo de tratamiento y vía de administración son variables en los diferentes estudios (55,63,64).
— La calcitonina se ha utilizado a dosis de 100 U/día s.c. o 200 U/día por vía nasal, aunque la evidencia de efectos beneficiosos es controvertida según autores. Dos ensayos clínicos de calcitonina en el SDRC, ambos identificados como estudios de alta calidad en una revisión sistemática, informaron resultados contradictorios. Uno encontró una mejoría en la intensidad del dolor después de 100 UI de calcitonina tres veces al día durante 3 semanas; el otro no informó mejoría después de 200 UI de calcitonina dos veces al día durante cuatro semanas. Su utilización requiere suplementos de calcio 4 horas después de su aplicación (65-70).
— Opioides: morfina, oxicodona, tramadol son utilizados como segunda línea de tratamiento en la fase aguda (71,72).
— Capsaicina: puede ser utilizada durante la fase aguda como crema, infusión, spray nasal y parche. Es intolerablemente doloroso, algo complicado e inaceptable para la mayoría de los pacientes Posee un bajo nivel de recomendación (73,74).
— Crema/ungüento: DMSO al 50 %. DMSO es un agente eliminador de radicales libres. En una revisión sistemática, el DMSO (crema al 50 % durante 2 meses) proporcionó una reducción significativa de los síntomas del SDRC en comparación con el placebo; sin embargo, la intensidad del dolor no mejoró (75,76).
— Parches cutáneos: fentanilo, lidocaína y clonidina. Algunos no se encuentran en el mercado local. Lidocaína: la importancia clínica del efecto de la lidocaína tópica consiste en la reducción de la alodinia severa. El alivio inmediato del dolor dado por la aplicación de lidocaína tópica permite al paciente realizar las sesiones de fisioterapia (74,77,78).
— NMDA: ketamina o magnesio EV. La ketamina se utiliza cuando el tratamiento con otras drogas es refractario. Es dada en bajas dosis EV durante algunos días. Son embargo algunos especialistas no la recomiendan porque puede inducir una entidad conocida como “ketamine bladder” (79-82).
Tratamientos invasivos
— Bloqueos: poseen bajo nivel de recomendación.
— Regional /periférico: ketorolaco y lidocaína o lidocaína sola proporcionan alivio a corto plazo.
— Bloqueo simpático lumbar: se bloquea en pacientes con SDRC con afectación de miembro inferior. El papel de estos bloqueos en el tratamiento es importante, ya que reduce el dolor y mejora la función para poder realizar el tratamiento rehabilitador. En trabajos realizados donde han sido comparados con placebo, los bloqueos con anestésico local han demostrado una duración del efecto analgésico significativamente mayor (83, 84).
— Ganglio estrellado: se bloquea en paciente con SDRC con afectación de miembro superior (85, 86).
— Bloqueo de plexo braquial: se implanta un catéter que se mantiene hasta 3 semanas. Se realiza una infusión continua de clonidina, anestésico local u opioide durante 2 a 3 semanas. Las complicaciones son: inyección intratecal, parálisis del nervio frénico, neumotórax, infección y sangrado (87, 88).
— Radiofrecuencia de la cadena simpática lumbar: se puede realizar en pacientes con bloqueo simpático lumbar positivo, consiguiendo un alivio del dolor superior a 6 meses de duración(89).
— Epidural: la analgesia epidural se realiza con la inyección de la medicación en el espacio epidural. Se administra a través de una bomba programable que la inyecta a través de un catéter colocado en el espacio epidural. Los medicamentos epidurales utilizados son clonidina con/sin bupivacaína. Se pueden administrar de forma continua o programar para que el paciente se autoadministre bolos pequeños para una analgesia óptima, según lo exijan los niveles de dolor (90-93).
— Baclofeno intratecal: puede considerarse la primera opción para el tratamiento de la distonía en el SDRC y tiene efectos analgésicos independientes de los efectos sobre la contracción muscular. Se puede considerar la primera opción para el tratamiento de la distonía en el SDRC y tiene efectos analgésicos independientes de los efectos sobre la contracción muscular. Estimula el receptor de ácido gammaaminobutírico (GABA) en las fibras aferentes primarias y actúa sobre el asta dorsal para inhibir la transmisión neuronal. Reduce el dolor y mejora la distonía y la calidad de vida (94).
— Toxina botulínica: la toxina botulínica inhibe la liberación de acetilcolina de las terminaciones nerviosas por lo que se ha propuesto para la distonía que se genera en el SDRC. Si la toxina botulínica mejora la distonía, mejora el dolor a pesar de que la distonía que se genera en el SDRC difiere a la que se ve en pacientes con enfermedades del sistema nervioso central (95-97).
— Neuro modulación: estimulación de la médula espinal: es un tratamiento costoso. Se realiza una prueba por unos días y semanas; si resulta exitosa para la reducción del dolor y otros síntomas se implantará el dispositivo definitivamente. La técnica consiste en la colocación de electrodos en la medula espinal (98-101).
— Calmare therapy: se ha utilizado para disminuir el dolor crónico. Utiliza métodos físicos parecidos al TENS pero con diferentes algoritmos. Envía una señal al cerebro para disminuir la transmisión del dolor. La frecuencia es de una terapia diaria de 35 minutos a lo largo de varias semanas (102, 103).
— La estimulación de la corteza motora (MCS, por sus siglas en inglés): es la forma más invasiva de tratamiento para el SDRC. El mecanismo de acción de la MCS es la modulación de la hiperactividad patológica en los núcleos de relevo talámicos. La desaferentación da como resultado la pérdida del control inhibitorio de las neuronas nociceptivas, y se ha demostrado que la MCS normaliza esta desinhibición en mayor medida que la estimulación de la corteza somatosensorial (104).
Conclusión
El SDRC es un trastorno doloroso y de difícil manejo. A pesar de los tratamientos disponibles y los que se encuentran en estudio, no existen protocolos estandarizados que permitan un abordaje interdisciplinario. La comprensión de la compleja fisiopatología ha logrado avances significativos, que llevarán a la mejoría en las terapias.
bibliografía
1. Hernández-Porras BC, Plancarte-Sánchez R, Alarcón-Barrios S, Sámano-García M. Síndrome doloroso regional complejo: revisión. Cirugía y Cirujanos. 2017;85(4):366-74. DOI: 10.1016/j.circir.2016.11.004.
2. Bean DJ, Johnson MH, Kydd RR. The outcome of complex regional pain syndrome type 1: a systematic review. J Pain. 2014;15(7):677-90. DOI: 10.1016/j.jpain.2014.01.500.
3. Maihöfner C, Seifert F, Markovic K. Complex regional pain syndromes: new pathophysiological concepts and therapies. Eur J Neurol. 2010;17(5):649-60. DOI: 10.1111/j.1468-1331.2010.02947.x.
4. Goh EL, Chidambaram S, Ma D. Complex regional pain syndrome: a recent update. Burns Trauma. 2017;5:2. DOI: 10.1186/s41038-016-0066-4.
5. Harden NR, Bruehl S, Perez R, Birklein F, Marinus J, Maihofner C, et al. Validation of proposed diagnostic criteria (the “Budapest Criteria”) for Complex Regional Pain Syndrome. Pain. 2010;150(2):268-74. DOI: 10.1016/j.pain.2010.04.030.
6. Martín FJ, de Andrés Ares J. Síndrome de dolor regional complejo: Claves diagnósticas para el médico no especialista. Revista Médica Clínica Las Condes. 2019;30(6):446-58. DOI: 10.1016/j.rmclc.2019.10.006.
7. Shim H, Rose J, Halle S, Shekane P. Complex regional pain syndrome: a narrative review for the practising clinician. Br J Anaesth. 2019;123(2):e424-e33. DOI: 10.1016/j.bja.2019.03.030.
8. Atero S, Peramo F, Cañas A, García Saura P, Serrano Álvarez C, Caballero J. Modulación descendente de la información nociceptiva (I). Rev Soc Esp Dolor. 2002;9:382-90.
9. Cuhadar U, Gentry C, Vastani N, Sensi S, Bevan S, Goebel A, et al. Autoantibodies produce pain in complex regional pain syndrome by sensitizing nociceptors. Pain. 2019;160(12):2855-65. DOI: 10.1097/j.pain.0000000000001662.
10. Guo T-Z, Wei T, Tajerian M, Clark JD, Birklein F, Goebel A, et al. Complex regional pain syndrome patient IgM has pronociceptive effects in the skin and spinal cord of tibia fracture mice. Pain. 2020;161(4):797. DOI: 10.1097/j.pain.0000000000001765.
11. Kopf A, Patel NB. Guía para el manejo del dolor en condiciones de bajos recursos [Internet]. Amazon Web Services; 2010. Disponible en: https://iaspfiles.s3.amazonaws.com/production/public/2021/IASP-Guide_to_Pain_Management_in_Low-Resource_Settings-Spanish.pdf
12. Cuenca González C, Flores Torres MI, Méndez Saavedra KV, Barca Fernández I, Alcina Navarro A, Villena Ferrer A. Síndrome doloroso regional complejo. Rev Clín Med Fam. 2012;5(2):120-9. DOI: 10.4321/S1699-695X2012000200007.
13. Krämer HH, Hofbauer LC, Szalay G, Breimhorst M, Eberle T, Zieschang K, et al. Osteoprotegerin: a new biomarker for impaired bone metabolism in complex regional pain syndrome? Pain. 2014;155(5):889-95. DOI: 10.1016/j.pain.2014.01.014.
14. Zimmerman RM, Astifidis RP, Katz RD. Modalities for Complex Regional Pain Syndrome. J Hand Surg Am. 2015;40(7):1469-72. DOI: 10.1016/j.jhsa.2015.03.010.
15. de Lossada CR, de Mora MRC, Ayala CH, Borroni D. Fotofobia y dolor neuropático en el síndrome de Sudeck. Arch Soc Esp Oftalmol. 2019;94(6):293-6. DOI: 10.1016/j.oftal.2018.11.011.
16. Drummond PD, Finch PM. Photophobia in complex regional pain syndrome: visual discomfort is greater on the affected than unaffected side. Pain. 2021;162(4):1233-40. DOI: 10.1097/j.pain.0000000000002118.
17. Drummond PD, Finch PM. Alteraciones auditivas en pacientes con sindrome de dolor regional complejo. Pain. 2023;164(4):804-10.
18. Veldman PH, Reynen HM, Arntz IE, Goris RJA. Signs and symptoms of reflex sympathetic dystrophy: prospective study of 829 patients. Lancet. 1993;342(8878):1012-6. DOI: 10.1016/0140-6736(93)92877-V.
19. Martínez EM, Canudas MVR, Idánez ÁM, Rebollo JM, Ripol PM, Custardoy AC, et al. Síndrome de dolor regional complejo. Sem Fund Esp Reumatol. 2012;13(1):31-6. DOI: 10.1016/j.semreu.2011.10.005.
20. Mesaroli G, Hundert A, Birnie KA, Campbell F, Stinson J. Screening and diagnostic tools for complex regional pain syndrome: a systematic review. Pain. 2021;162(5):1295. DOI: 10.1097/j.pain.0000000000002146.
21. Fletcher GS. Clinical epidemiology: the essentials: Lippincott Williams & Wilkins; 2019.
22. Sumitani M, Shibata M, Sakaue G, Mashimo T, Group JCR. Development of comprehensive diagnostic criteria for complex regional pain syndrome in the Japanese population. Pain. 2010;150(2):243-9. DOI: 10.1016/j.pain.2010.03.032.
23. Classification of chronic pain. Descriptions of chronic pain syndromes and definitions of pain terms. Prepared by the International Association for the Study of Pain, Subcommittee on Taxonomy. Pain Suppl. 1986;3:S1-226.
24. Evans JA. Reflex sympathetic dystrophy. Surg Clin North Am. 1946 Jun;26:780-90.
25. Bruehl S, Harden NR, Galer BS, Saltz S, Bertram M, Backonja M, et al. External validation of IASP diagnostic criteria for complex regional pain syndrome and proposed research diagnostic criteria. Pain. 1999;81(1):147-54. DOI: 10.1016/S0304-3959(99)00011-1.
26. Harden RN, Bruehl S, Stanton-Hicks M, Wilson PR. Proposed new diagnostic criteria for complex regional pain syndrome. Pain Med. 2007;8(4):326-31. DOI: 10.1111/j.1526-4637.2006.00169.x.
27. Harden RN, McCabe CS, Goebel A, Massey M, Suvar T, Grieve S, et al. Complex regional pain syndrome: practical diagnostic and treatment guidelines. Pain Med. 2022;23(Supplement_1):S1-S53. DOI: 10.1093/pm/pnac046.
28. Gudmundsson KG. Complex regional pain syndrome, CRPS. Laeknabladid. 2021;107(6):288-96.
29. Bazika-Gerasch B, Maier C, Kumowski N, Fiege C, Kaisler M, Vollert J, et al. Compared to limb pain of other origin, ultrasonographic osteodensitometry reveals loss of bone density in complex regional pain syndrome. Pain. 2019;160(6):1261-9. DOI: 10.1097/j.pain.0000000000001520.
30. Tabach-Apraiz A, Lorena-Oyanadel M, Gutiérrez-Espinoza H, Bueno-Buker D. Efectos del tratamiento multimodal en pacientes con síndrome de dolor regional complejo tipo 1 con, al menos, seis meses de evolución: un estudio descriptivo. Rev Soc Esp Dolor. 2019;26(1):6-13. DOI: 10.20986/resed.2018.3651/2018. DOI: 10.20986/resed.2018.3651/2018.
31. Harden RN, Oaklander AL, Burton AW, Perez RS, Richardson K, Swan M, et al. Complex regional pain syndrome: practical diagnostic and treatment guidelines. Pain Med. 2013;14(2):180-229. DOI: 10.1111/pme.12033.
32. Severens JL, Oerlemans HM, Weegels AJ, van’t Hof MA, Oostendorp RA, Goris RJA. Cost-effectiveness analysis of adjuvant physical or occupational therapy for patients with reflex sympathetic dystrophy. Arch Phys Med Rehabil. 1999;80(9):1038-43. DOI: 10.1016/S0003-9993(99)90057-6.
33. Carlson LK, Watson HK. Treatment of reflex sympathetic dystrophy using the stress-loading program. J Hand Ther. 1988;1(4):149-54. DOI: 10.1016/S0894-1130(88)80022-X.
34. Watson HK, Carlson L. Treatment of reflex sympathetic dystrophy of the hand with an active “stress loading” program. The Journal of hand surgery. 1987;12(5):779-85. DOI: 10.1016/S0363-5023(87)80069-2.
35. McCabe CS, Haigh RC, Ring E, Halligan PW, Wall PD, Blake DR. A controlled pilot study of the utility of mirror visual feedback in the treatment of complex regional pain syndrome (type 1). Rheumatol. 2003;42(1):97-101. DOI: 10.1093/rheumatology/keg041.
36. Ramachandran VS, Rogers-Ramachandran D. Synaesthesia in phantom limbs induced with mirrors. Proc Biol Sci. 1996;263(1369):377-86. DOI: 10.1098/rspb.1996.0058.
37. Méndez-Rebolledo G, Gatica-Rojas V, Torres-Cueco R, Albornoz-Verdugo M, Guzmán-Muñoz E. Update on the effects of graded motor imagery and mirror therapy on complex regional pain syndrome type 1: A systematic review. J Back Musculoskelet Rehabil. 2017;30(3):441-9. DOI: 10.3233/BMR-150500.
38. Johnson S, Hall J, Barnett Sa, Draper M, Derbyshire G, Haynes L, et al. Using graded motor imagery for complex regional pain syndrome in clinical practice: failure to improve pain. Eur J Pain. 2012;16(4):550-61. DOI: 10.1002/j.1532-2149.2011.00064.x.
39. McCabe C. Mirror visual feedback therapy. A practical approach. J Hand Ther. 2011;24(2):170-9. DOI: 10.1016/j.jht.2010.08.003.
40. Moseley GL. Graded motor imagery is effective for long-standing complex regional pain syndrome: a randomised controlled trial. Pain. 2004;108(1-2):192-8. DOI: 10.1016/j.pain.2004.01.006.
41. Halicka M, Vittersø AD, McCullough H, Goebel A, Heelas L, Proulx MJ, et al. Prism adaptation treatment for upper-limb Complex Regional Pain Syndrome: a double-blind randomized controlled trial. Pain. 2021;162(2):471. DOI: 10.1097/j.pain.0000000000002053.
42. Schencking M, Bohmhammel J, Keller C. Stationare, naturheilkundliche Therapie eines komplexen regionalen Schmerzsyndroms (CRPS I). Forsch Komplementmed. 2009;16(2):117-22. DOI: 10.1159/000210561.
43. Bilgili A, Çakır T, Doğan ŞK, Erçalık T, Filiz MB, Toraman F. The effectiveness of transcutaneous electrical nerve stimulation in the management of patients with complex regional pain syndrome: a randomized, double-blinded, placebo-controlled prospective study. Journal of back and musculoskeletal rehabilitation. 2016;29(4):661-71. DOI: 10.3233/BMR-160667.
44. Fialka V, Korpan M, Nikoliakis P, Iu D, Schneider I, Leita T. Acupuncture in the treatment of a posttraumatic pain syndrome. Likars’ ka Sprava. 1998(7):152-4.
45. Wang WY, Wan FM, Ding SQ. [Clinical observation of Jingu three-needle therapy combined with Xingnao Kaiqiao acupuncture on complex regional pain syndrome after stroke]. Zhongguo Zhen Jiu. 2019 Dec 12;39(12):1262-6.
46. Kiralp M, Yildiz Ş, Vural D, Keskin I, Ay H, Dursun H. Effectiveness of hyperbaric oxygen therapy in the treatment of complex regional pain syndrome. J Int Med Res. 2004;32(3):258-62. DOI: 10.1177/147323000403200304.
47. Taha R, Blaise GA. Update on the pathogenesis of complex regional pain syndrome: role of oxidative stress. Can J Anaesth. 2012:1-7.
48. Baykal T, Seferoglu B, Karsan O, Kiziltunc A, Senel K. Antioxidant profile in patients with complex regional pain syndrome type I. Int J Rheum Dis. 2014;17(2):156-8. DOI: 10.1111/1756-185X.12140.
49. Guo T-Z, Wei T, Huang T-T, Kingery WS, Clark JD. Oxidative stress contributes to fracture/cast-induced inflammation and pain in a rat model of complex regional pain syndrome. J Pain. 2018;19(10):1147-56. DOI: 10.1016/j.jpain.2018.04.006.
50. Shearer HM, Trim A. An unusual presentation and outcome of complex regional pain syndrome: a case report. The Journal of the Canadian Chiropractic Association. 2006;50(1):20.
51. Daffonchio L, Rossoni G, Clavenna G, Omini C, Berti F. Protective activity of ketoprofen lysine salt against the pulmonary effects induced by bradykinin in guinea-pigs. Infl Res. 1996;45:259-64. DOI: 10.1007/BF02259613.
52. Boughton-Smith N, Whittle B. Stimulation and inhibition of prostacyclin formation in the gastric mucosa and ileum in vitro by anti-inflammatory agents. Br J Pharmacol. 1983;78(1):173. DOI: 10.1111/j.1476-5381.1983.tb09378.x.
53. Hennekens CH, Borzak S. Cyclooxygenase-2 inhibitors and most traditional nonsteroidal anti-inflammatory drugs cause similar moderately increased risks of cardiovascular disease. J Cardiovasc Pharmacol Ther. 2008;13(1):41-50. DOI: 10.1177/1074248407312990.
54. Christensen K, Jensen E, Noer I. The reflex dystrophy syndrome response to treatment with systemic corticosteroids. Acta Chirurgica Scandinavica. 1982;148(8):653-5.
55. Sindrup SH, Jensen TS. Efficacy of pharmacological treatments of neuropathic pain: an update and effect related to mechanism of drug action. Pain®. 1999;83(3):389-400. DOI: 10.1016/S0304-3959(99)00154-2.
56. McQuay H, Tramer M, Nye B, Carroll D, Wiffen P, Moore R. A systematic review of antidepressants in neuropathic pain. Pain. 1996;68(2-3):217-27. DOI: 10.1016/S0304-3959(96)03140-5.
57. Mellick GA, Mellick LB. Reflex sympathetic dystrophy treated with gabapentin. Archives of physical medicine and rehabilitation. 1997;78(1):98-105. DOI: 10.1016/S0003-9993(97)90020-4.
58. van de Vusse AC, Goossens VJ, Kemler MA, Weber WE. Screening of patients with complex regional pain syndrome for antecedent infections. Clin J Pain. 2001;17(2):110-4. DOI: 10.1097/00002508-200106000-00002.
59. Burchiel KJ. Carbamazepine inhibits spontaneous activity in experimental neuromas. Exp Neurol. 1988;102(2):249-53. DOI: 10.1016/0014-4886(88)90101-X.
60. Rull J, Quibrera R, Gonzalez-Millan H, Castaneda OL. Symptomatic treatment of peripheral diabetic neuropathy with carbamazepine (Tegretol): double blind crossover trial. Diabetologia. 1969;5(4):215-8. DOI: 10.1007/BF01212087.
61. Harke H, Gretenkort P, Ladleif HU, Rahman S, Harke O. The response of neuropathic pain and pain in complex regional pain syndrome I to carbamazepine and sustained-release morphine in patients pretreated with spinal cord stimulation: a double-blinded randomized study. Anesth Analg. 2001;92(2):488-95. DOI: 10.1213/00000539-200102000-00039.
62. Shorvon S. Oxcarbazepine: a review. Seizure. 2000;9(2):75-9. DOI: 10.1053/seiz.2000.0391.
63. Vannala V, Palaian S, Shankar PR. Therapeutic dimensions of bisphosphonates: a clinical update. Int J Prev Med. 2020;11.
64. Varenna M, Adami S, Rossini M, Gatti D, Idolazzi L, Zucchi F, et al. Treatment of complex regional pain syndrome type I with neridronate: a randomized, double-blind, placebo-controlled study. Rheumatol. 2013;52(3):534-42. DOI: 10.1093/rheumatology/kes312.
65. Schürmann M, Vogel T, Gärtner A, Andress H, Gradl G. Experiences with calcitonin treatment of patients with type I complex regional pain syndrome (CRPS I--Sudeck disease). Z Orthop Ihre Grenzgeb. 2001;139(5):452-7. DOI: 10.1055/s-2001-17990.
66. Sahin F, Yilmaz F, Kotevoglu N, Kuran B. Efficacy of salmon calcitonin in complex regional pain syndrome (type 1) in addition to physical therapy. Clin Rheumatol. 2006;25:143-8. DOI: 10.1007/s10067-005-1153-2.
67. Matayoshi S, Shimodozono M, Hirata Y, Ueda T, Horio S, Kawahira K. Use of calcitonin to prevent complex regional pain syndrome type I in severe hemiplegic patients after stroke. Disability and rehabilitation. 2009;31(21):1773-9. DOI: 10.1080/09638280902795573.
68. Yazdani J, Khorshidi Khiavi R, Ghavimi MA, Mortazavi A, Jabbari Hagh E, Ahmadpour F. Calcitonina como agente analgésico: revisão dos mecanismos de ação e das aplicações clínicas. Revista Brasileira de Anestesiologia. 2020;69:594-604.
69. Bickerstaff D, Kanis J. The use of nasal calcitonin in the treatment of post-traumatic algodystrophy. Rheumatology. 1991;30(4):291-4. DOI: 10.1093/rheumatology/30.4.291.
70. Gobelet C, Meier J-L, Schaffner W, Bischof-Delaloye A, Gerster J-C, Burckhardt P. Calcitonin and reflex sympathetic dystrophy syndrome. Clin Rheumatol. 1986;5:382-8. DOI: 10.1007/BF02054258.
71. Ebert B, Andersen S, Krogsgaard-Larsen P. Ketobemidone, methadone and pethidine are non-competitive N-methyl-D-aspartate (NMDA) antagonists in the rat cortex and spinal cord. Neurosci Lett. 1995;187(3):165-8. DOI: 10.1016/0304-3940(95)11364-3.
72. Roulet L, Rollason V, Desmeules J, Piguet V. Tapentadol versus tramadol: A narrative and comparative review of their pharmacological, efficacy and safety profiles in adult patients. Drugs. 2021;81(11):1257-72. DOI: 10.1007/s40265-021-01515-z.
73. Robbins WR, Staats PS, Levine J, Fields HL, Allen RW, Campbell JN, et al. Treatment of intractable pain with topical large-dose capsaicin: preliminary report. Anesth Analg. 1998;86(3):579-83. DOI: 10.1213/00000539-199803000-00027.
74. Chang A, Rosani A, Quick J. Capsaicin. StatPearls; 2023.
75. Zuurmond W, Langendijk P, Bezemer P, Brink H, De Lange J, Van Loenen A. Treatment of acute reflex sympathetic dystrophy with DMSO 50% in a fatty cream. Acta Anaesthesiologica Scandinavica. 1996;40(3):364-7. DOI: 10.1111/j.1399-6576.1996.tb04446.x.
76. Forouzanfar T, Köke AJ, Van Kleef M, Weber WE. Treatment of complex regional pain syndrome type I. Eur J Pain. 2002;6(2):105-22. DOI: 10.1053/eujp.2001.0304.
77. Attal N, Brasseur L, Chauvin M, Bouhassira D. Effects of single and repeated applications of a eutectic mixture of local anaesthetics (EMLA®) cream on spontaneous and evoked pain in post-herpetic neuralgia. Pain. 1999;81(1-2):203-9. DOI: 10.1016/S0304-3959(99)00014-7.
78. Rowbotham MC, Davies PS, Verkempinck C, Galer BS. Lidocaine patch: double-blind controlled study of a new treatment method for post-herpetic neuralgia. Pain. 1996;65(1):39-44. DOI: 10.1016/0304-3959(95)00146-8.
79. Hunt JA, Lake MA. Reviewing the physiology, pharmacology and therapeutic uses of ketamine. Nursing Standard (Royal College of Nursing (Great Britain): 1987). 2021;36(9):77-81.
80. Sigtermans MJ, Van Hilten JJ, Bauer MC, Arbous MS, Marinus J, Sarton EY, et al. Ketamine produces effective and long-term pain relief in patients with Complex Regional Pain Syndrome Type 1. Pain. 2009;145(3):304-11. DOI: 10.1016/j.pain.2009.06.023.
81. Goebel A, Jayaseelan S, Sachane K, Gupta M, Frank B. Racemic ketamine 4.5-day infusion treatment of long-standing complex regional pain syndrome—a prospective service evaluation in five patients. Br J Anaesth. 2015;115(1):146-7. DOI: 10.1093/bja/aev183.
82. Pickering AE, McCabe CS. Prolonged ketamine infusion as a therapy for complex regional pain syndrome: synergism with antagonism? Br J Clin Pharmacol. 2014;77(2):233. DOI: 10.1111/bcp.12157.
83. Boas RA. Sympathetic nerve blocks: in search of a role. Reg Anesth Pain Med. 1998;23(3):292-305. DOI: 10.1097/00115550-199823030-00012.
84. Cepeda MS, Lau J, Carr DB. Defining the therapeutic role of local anesthetic sympathetic blockade in complex regional pain syndrome: a narrative and systematic review. Clin J Pain. 2002;18(4):216-33. DOI: 10.1097/00002508-200207000-00002.
85. Malmqvist EL-Å, Bengtsson M, Sörensen J. Efficacy of stellate ganglion block: a clinical study with bupivacaine. Reg Anesth. 1992;17(6):340-7.
86. Schürmann M, Gradl G, Wizgal I, Tutic M, Moser C, Azad S, et al. Clinical and physiologic evaluation of stellate ganglion blockade for complex regional pain syndrome type I. The Clin J Pain. 2001;17(1):94-100. DOI: 10.1097/00002508-200103000-00012.
87. RAJ PP, Montgomery S, Nettles D, Jenkins M. Infraclavicular Brachial Plexus Block-A New Approach. Anesth Analg. 1973;52(6):897-903. DOI: 10.1213/00000539-197311000-00007.
88. Wang L-K, Chen H-P, Chang P-J, Kang F-C, Tsai Y-C. Axillary brachial plexus block with patient controlled analgesia for complex regional pain syndrome type I: A case report. Reg Anesth Pain Med. 2001;26(1):68-71.
89. Lozano-Gómez M, Relaño-Cobian M, Espinosa-García A, de-la-Pinta-García JC. Manejo de síndrome de dolor regional complejo: a propósito de un caso. Rev Soc Esp Dolor. 2018;25(3):163-5. DOI: 10.20986/resed.2018.3636/2017.
90. Cooper DE, DeLee J, Ramamurthy S. Reflex sympathetic dystrophy of the knee. Treatment using continuous epidural anesthesia. J Bone Joint Surg Am. 1989;71(3):365-9. DOI: 10.2106/00004623-198971030-00009.
91. Buchheit T, Crews JC. Lateral cervical epidural catheter placement for continuous unilateral upper extremity analgesia and sympathetic block. Regional Anesthesia and Pain Medicine. 2000;25(3):313-7. DOI: 10.1097/00115550-200005000-00020.
92. Koning H, Christiaans C, Overdijk G, Mackie D. Cervical epidural blockade and reflex sympathetic dystrophy. Pain Clinic. 1995;8(3):239-44.
93. Rauck RL, Eisenach JC, Jackson KE, Speight KL, Southern JP, editors. Epidural clonidine for refractory reflex sympathetic dystrophy. The Journal of the American Society of Anesthesiologists; 1991. DOI: 10.1097/00000542-199109001-00656.
94. van Hilten BJ, van de Beek W-JT, Hoff JI, Voormolen JH, Delhaas EM. Intrathecal baclofen for the treatment of dystonia in patients with reflex sympathetic dystrophy. New Eng J Med. 2000;343(9):625-30. DOI: 10.1056/NEJM200008313430905.
95. Marsili L, Bologna M, Jankovic J, Colosimo C. Long-term efficacy and safety of botulinum toxin treatment for cervical dystonia: A critical reappraisal. Expert Opin Drug Saf. 2021;20(6):695-705. DOI: 10.1080/14740338.2021.1915282.
96. Ranoux D, Attal N, Morain F, Bouhassira D. Botulinum toxin type A induces direct analgesic effects in chronic neuropathic pain. Ann Neurol. 2008;64(3):274-83. DOI: 10.1002/ana.21427.
97. Carroll I, Clark JD, Mackey S. Sympathetic block with botulinum toxin to treat complex regional pain syndrome. Ann Neurol. 2009;65(3):348-51. DOI: 10.1002/ana.21601.
98. Ruiz-López I, Martínez-Fuentes J. Eficacia de la estimulación eléctrica medular en el síndrome de dolor regional complejo tipo I: revisión bibliográfica. Rev Soc Esp dDolor. 2017;24(4):169-78.
99. Sears NC, Machado AG, Nagel SJ, Deogaonkar M, Stanton-Hicks M, Rezai AR, et al. Long-term outcomes of spinal cord stimulation with paddle leads in the treatment of complex regional pain syndrome and failed back surgery syndrome. Neuromodulation. 2011;14(4):312-8. DOI: 10.1111/j.1525-1403.2011.00372.x.
100. Taylor RS. Spinal cord stimulation in complex regional pain syndrome and refractory neuropathic back and leg pain/failed back surgery syndrome: results of a systematic review and meta-analysis. Journal of pain and symptom management. 2006;31(4):S13-S9. DOI: 10.1016/j.jpainsymman.2005.12.010.
101. Kemler MA, De Vet HC, Barendse GA, Van den Wildenberg FA, Van Kleef M. Effect of spinal cord stimulation for chronic complex regional pain syndrome Type I: five-year final follow-up of patients in a randomized controlled trial. J Neurosurg. 2008;108(2):292-8. DOI: 10.3171/JNS/2008/108/2/0292.
102. Raucci U, Tomasello C, Marri M, Salzano M, Gasparini A, Conicella E. Scrambler Therapy® MC-5A for Complex Regional Pain Syndrome. Pain Pract. 2016;16(7):E103-E9. DOI: 10.1111/papr.12474.
103. Marineo G. Inside the scrambler therapy, a noninvasive treatment of chronic neuropathic and cancer pain: from the gate control theory to the active principle of information. Integr Cancer Ther. 2019;18:1534735419845143. DOI: 10.1177/1534735419845143.
104. Ostergard T, Munyon C, Miller JP. Motor cortex stimulation for chronic pain. Neurosurg Clin N Am. 2014;25(4):693-8. DOI: 10.1016/j.nec.2014.06.004.